Inscription / Connexion Nouveau Sujet
Titre Hydrotimètrique (°TH) de l'eau
Bonjour 
J'aimerais que vous me corrigiez si il y'a une erreur, et surtout de l'aide pour la question 7 .
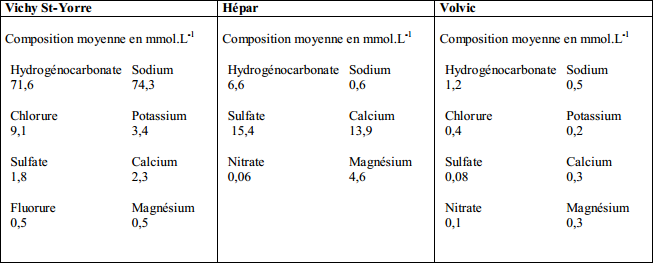
Voir tableau
1°) Vérifier que le degré hydrotimétrique de l'eau Hépar est de 185°TH.
=> La dureté de l'eau dépend principalement de la concentration des ions de calcium (Ca2+) et des ions de magnésium (Mg2+).
Donc pour l'eau Hépar on fait 13,9 + 4,6 = 18,5 mmol.L-1 ce qui équivaut à 185°TH.
2°) Déterminer le degré hydrotimétrique de la Vichy St-Yorre et de la Volvic.
=> Pour la Vichy
2,3 + 0,5 = 2,8 mmol.L-1
donc 28°TH
Pour la Volvic
0,3 + 0,3 = 0,6 mmol.L-1
donc 6°TH
3°) En déduire l'eau minérale la plus dure.
=> L'eau minérale la plus dure est l'Hépar car c'est celle qui contient un plus grand nombres d'ions impliqués.
Je veux maintenant déterminer la solubilité du calcaire CaCO3 à 20°C dans l'eau pure.
J'essaie donc de dissoudre 5,00 x 10 -5 mol de calcaire dans 200,0 mL d'eau.
4°) Rappelez la définition de la solubilité d'une espèce chimique.
=> La solubilité d'une espèce chimique correspond à la asse maximale de cet espèce que l'on peut dissoudre dans 1L de solvant?
5°) Déterminez la masse molaire du calcaire
=> 100,1 g.mol-1
6°) Montrez que la masse du calcaire introduite est de 5,00 mg
=> m = n x M
m = 5,00 x 10 -5 x 100,1
m = 0,00500 g
m = 5,00 mg
Il reste une masse de 1,8 mg de calcaire qui refuse de se dissoudre.
7°) Déduisez-en la solubilité s du calcaire à 20°C dans l'eau pure
=> et la je vois pas quel calcul faut-il faire? :/
Merci d'avance.
Salut,
Il reste une masse de 1,8 mg de calcaire qui refuse de se dissoudre.
donc la masse de calcaire qui se dissout effectivement est (,0 - 1,8 mg
donc tu peux connaître la solubilité du calcaire dans l'eau :
s = m/V





