Inscription / Connexion Nouveau Sujet
Titrage
Bonjour je coince sur un exercice.
Quelle est la concentration d'une solution d'hydroxyde de potassium utilisée pour titrer complètement 10mL d'acide phosphoreux ?
Sachant que l'équivalence est atteinte après ajout de 13,4mL de titrant et que la concentration du titré est de 0,749M
La bonne réponse est 1,12M mais je trouve 1,67M
Et effet on sait qu'il faut la même quantité de Base que d'acide pour titrer complétement.
L'équation est donc 3KOH+H3PO3 => 3H20 + K3PO3
Je trouve donc à l'équivalence que n(KOH)/3 = n(H3PO3)
Donc C(NAOH) = 3x0,010x0,749 / 0,0134 = 1,67 M
Merci pour votre aide 
Bonjour,
Votre raisonnement est correct MAIS il se trouve que la troisième acidité est faible et non dosable, on ne dose que les deux premières acidités.
Aviez-vous une courbe pH(v), ou d'autres indications ?
d'accord merci pour votre réponse
Non rien d'autre, à mon niveau je ne pouvais pas trop le deviner de ce fait enfin les autres réponses étaient quand même assez éloignées
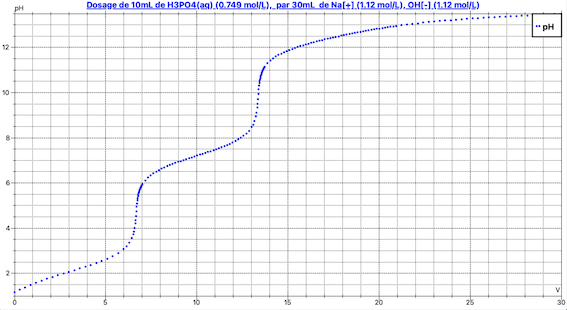
Ci-joint, une courbe simulée : on voit bien deux équivalences et pas la troisième.
Sans indication supplémentaire, vous ne pouviez deviner.