Inscription / Connexion Nouveau Sujet
Tableau d'avancement
Bonjour je suis bloqué à un exercice pouvez-vous m'aider
voici l'énoncé:
L'aluminium est attaqué par une solution d'hydroxyde de sodium (soude). Il se forme de l'aluminate de sodium et du dihydrogène . L'équation chimique associé est :
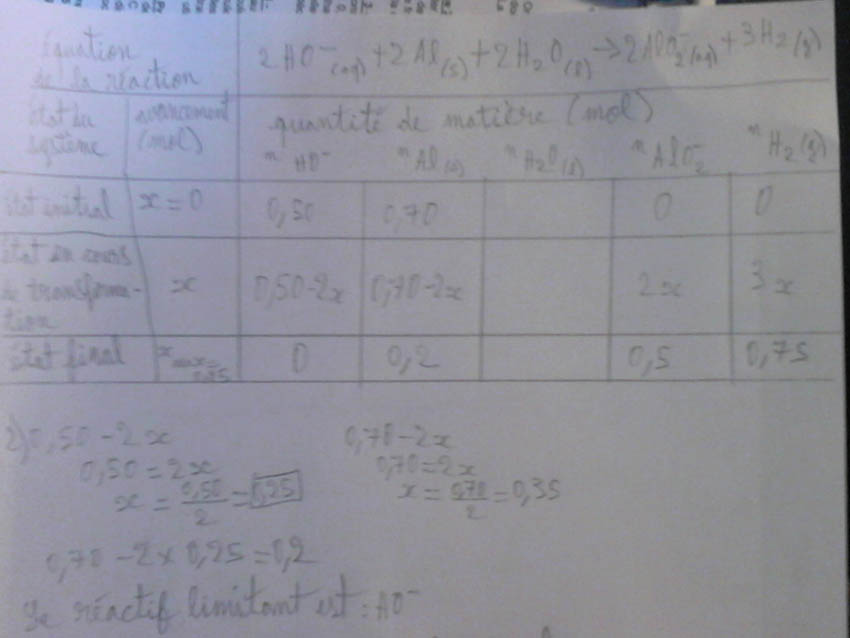
2Ho-(aq)+2Al(s)+2H2O(l)  2AlO2-(aq)+3H2(g)
2AlO2-(aq)+3H2(g)
Pour préparer cette solution , on fait réagir un volume V1=100ml de solution d'hydroxyde de sodium de concentration C1=5.00 mol.L^-1 sur une masse m=19.1g de poudre d'aluminium . L'eau est en excès.
1) calculer les quantité de matière initiales d'aluminium et d'ions hydroxyde
2)Déterminer le réactif limitant et donner la valuer de l'avancement maximal à l'aide d'un tableau d'avancement.
3) effectuer un bilan de matière à l'état final
Ce que j'ai fais:
1) Al: n=m/M n=19.1/27.0=0.70 mol
Ho-: n=C*Vsol n=5.00*0.100=0.5 mol
2) voir photo ci-dessous ;avancement max= 0.25
Par contre je sèche pour trouver la quantité de matière de l'eau (c'est là où je bloque)
3) Bilan de matière à l'état final:
(Il manque l'eau j'ai pas trouvé) O mol de HO-; 0.2 mol de Al ; 0.5 mol de Al0-(s) et 0.75 mol de H2(g)
Est-ce que tout est correct ?
ok donc il faut que je marque excès dans la colonne nH2O pour état initial; état en cours de transformation et état final
n'est ce pas ?




