Inscription / Connexion Nouveau Sujet
Synthèse de l’indigo
Bonjour, voila j'ai un petit problème avec un exercice le voici :
Synthèse de l'indigo
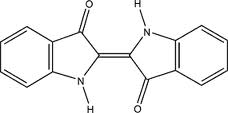
1. Quelle est la formule brute de l'indigo ?
2. Quelles sont les fonctions chimiques présentes dans l'indigo ?
3. Cette molécule possède deux stéréoisomères. Quel est le stéréoisomère représenté ci-dessus ? Pourquoi est-il plus stable que l'autre ?
Synthèse de l'indigo
Il est recommandé de travailler sous la hotte.
Dans un erlenmeyer de 125 mL, verser 1,0 g de 2-nitrobenzaldéhyde, 20 mL d'acétone et 35 mL d'eau distillée.
Agiter très vivement à l'aide d'un agitateur magnétique.
Ajouter lentement 5 mL de solution de soude.
Attention : La soude est préparée par dissolution de 8 g de soude en pastille dans 100 mL d'eau. Il faut porter gants et lunettes pour manipuler cette solution.
La solution passe de la couleur jaune foncé à une couleur plus sombre. L'indigo précipite.
Après quelques minutes, filtrer sur Büchner. Laver le précipité avec de l'eau jusqu'à ce que le filtrat soit incolore.
Laver avec 40 mL d'éthanol. Laisser sécher le solide ou le passer à l'étuve vers 120°C.
4. Quels sont les dangers liés à la soude ?
5. Quelle est la concentration molaire de la solution de soude utilisée ?
6. Quelle est la couleur de l'indigo obtenue ?
7. L'indigo est-il soluble dans l'eau ?
8. Sachant qu'une mole de 2-nitrobenzaldéhyde permet d'obtenir, avec la quantité suffisante d'acétone en milieu basique, deux moles d'indigo, quelle masse d'indigo peut-on espérer obtenir ?
J'ai calculé la masse molaire du 2-nitrobenzaldéhyde qui fait 151 mol-1 mais après je ne sais plus quoi faire
9. En déduire le rendement de la synthèse.
Je n'ai aucun problème avec les questions 1)2)3)4)5)6)7) mais je n'arrive pas à résoudre la 8) et la 9) même après des recherches je suis perdu Pouvez-vous m'aider
Merci d'avance
8) Je pense qu'il faut que tu trouves le nombre de moles du réactif: 2-nitrobenzaldéhyde pour en déduire le nombre de moles de produit: l'indigo pour ensuite en déduire la masse d'indigo formé.
Alors on va faire par étapes:
tu cherches la quantité de matière (nombre de moles) du 2-nitrobenzaldéhyde ,
tu as la masse et la masse molaire
quelle est la formule à utiliser?
Salut, j'ai le même DM et moi j'ai dit que comme on a deux moles d'indigo avec une mole de 2-nitrobenzaldéhyde , on espère avoir 2g d'indigo avec 1g de 2-nitrobenzaldéhyde (*2). Mais la question 3 si tu pourrais m'aider s ça serai sympa.
oui c'est ça.
Tu peux donc calculer n pour le 2-nitrobenzaldéhyde .
Ensuite, pour 1 mole de 2-nitrobenzaldéhyde on produit 2 moles d 'indigo selon l'énoncé.
A partir de la valeur de n du 2-nitrobenzaldéhyde que tu viens de calculer, tu peux trouver facilement la valeur de n de l'indigo.
walala, tu ne peux pas raisonner avec les masses.
doubler le nombre de moles ne veut pas dire doubler la masse...
T'as la réponse dam1ens ? ( Pour la question 9, Le rendement, c'est un pourcentage pour savoir si la synthèse est "rentable" ou pas.Pour calculer un rendement, tu fais le rapport entre:
- ce que tu aurais pu obtenir au maximum
- ce que tu obtiens rééllement. A la fin du doit avoir un pourcentage.)
Ici les groupes identiques ne sont pas du même côté, c'est donc l'isomère Z si je me souviens bien.
Ensuite pour la stabilité: 2 groupes =O proches vont se repousser ainsi que deux atomes H, alors que le H à côté d'un O vont s'attirer.
(le O est electronégatif et ici, le H est électropositif car les electrons sont "attirés" vers le N)
Quel est le plus stable à ton avis?.
je n'ai pas la réponse pour la 9
T'as la réponse dam1ens ? ( Pour la question 9, Le rendement, c'est un pourcentage pour savoir si la synthèse est "rentable" ou pas.Pour calculer un rendement, tu fais le rapport entre:
- ce que tu aurais pu obtenir au maximum
- ce que tu obtiens rééllement. A la fin du doit avoir un pourcentage.)
merci
Le plus stable est celui du dessus (il le dise dans l'énoncé). Peut être parce qu'il est plus proche de la réalité.
Oups, pour la stéréoisomérie:
H H H Cl
\ / \ /
C = C C = C
/ \ / \
Cl Cl Cl H
Isomérie Cis ou Z Isomérie Trans ou E
Merci wikipedia 
Oui, si il est plus stable, alors il existera en plus grand nombre dans la réalité. Mais ce n'est pas la raison.
Réfléchis avec les histoires d'attirance et de répulsion.
Si deux groupes se repoussent, sera-t-il facile de les éloigner ou difficile par rapport à si ils s'attirent?
Le plus stable est le plus difficile à "modifier"
tu as la formule réduite de la molécule ou tu as trouvé 151 à partir de la représentation? Je n'ai pas trouvé ça, mais j'ai pu me tromper...
donc
n=m/M
n=1/262
n=0.00381679389313
avec ça je fais comment pour trouver la valeur de n de l'indigo ????
Non, on fait je me suis embrouillée avec les 2 questions.
Donc on revient sur la 2-nitrobenzaldéhyde
7x12+9x1+14+3x16=155
Je trouve donc 155
Je vais résumer parce que tu dois etre bien embrouillé là:
8. Sachant qu'une mole de 2-nitrobenzaldéhyde permet d'obtenir, avec la quantité suffisante d'acétone en milieu basique, deux moles d'indigo, quelle masse d'indigo peut-on espérer obtenir ?
*On cherche n pour le 2-nitrobenzaldéhyde.
On utilise donc n=m/M
AN donne n=1/155 si mes calculs sont justes.
(je trouve 155 pour la masse molaire du 2-nitrobenzaldéhyde.)
la je suis completement perdu
donc
n=m/M
n=1/155 (et pas 151 je me suis trompé)
mais après que faut-il faire???
sauf si la formule du 2-nitrobenzaldéhyde. c'est C6H5NO3 et pas C6H9NO3 (faute de frappe) ou là effectivement ca fait 151
Ensuite, tu sais que tu as au départ de la réaction n=1/151 mol.
Tu vas donc produire combien de moles d'indigo?
Maintenant que tu as le nombre de moles de l'indigo, tu peux, en utilisant la même formule n=m/M calculer la masse d'indigo.
Evidemment pour ca il faut avoir la masse molaire M de l'indigo.
oui voilà, le calcul est correct.
Donc tu peux calculer la masse d'indigo à partir de la quantité de matière.
Alors ici tu cherches la masse m.
Il faut isoler m avant de pouvoir faire la calcul.
Si n=m/M alors m=?
Non, ce n'est pas ce resultat là.
Ca c'est faux. Tu avais trouvé n(2 nitrobenzaldéhyde)=2/151
Donc on remplace dans m=nxM