Inscription / Connexion Nouveau Sujet
Sujet Bac équilibre acide base
Bonjour,
Je bloque sur une question d'un sujet bac : https://***lien supprimé***![]() [***A LIRE AVANT D'AGIR***] Règles du forum
[***A LIRE AVANT D'AGIR***] Règles du forum
la 3.3 où je trouve des résultats abérrants.
Sinon est il possible de vérifier la concordance de mes autres résultats
1.1 amphotère
1. 2pkA2=7
1.3 HSO3- prédomine entre les deux pka
1.4 HS03- prédomine
2.1 H2SO3-+H2O->HSO3-+H3O+
2.3 3.2x10^-3 mol/L
2.4 3.2x10^-3 mol/L
2.5 6.3*10^-4mol/L cela confirme.
3.1 H2SO3 est un acide plus fort car pka plus faible
3.2. HSO4-/SO4-
3.3 ?
Je remercie tout ceux qui prendront la peine de m'aider.
Cordialement
le sujet :
1. Acide sulfureux
1.1 Préciser le terme permettant de qualifier
HSO ( 3 aq). -
Identifier la base associée à HSO3
-
(aq)
correspondant au deuxième couple ainsi que la
demi-équation.
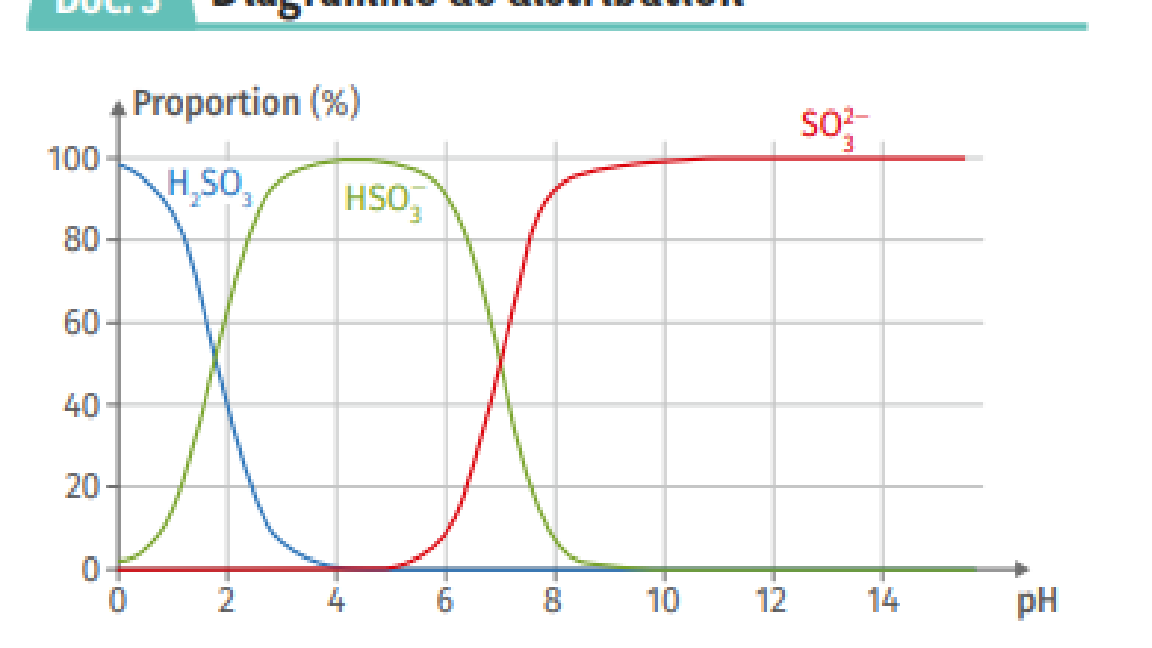
À l'intersection entre les courbes rouge et verte sur le
diagramme de distribution, les concentrations des deux
espèces associées sont égales en raison de leur proportion équivalente.
1.2 À partir de ce diagramme, déterminer la valeur du
pKA2 en expliquant la démarche.
1.3 Tracer le diagramme de prédominance des trois
espèces étudiées
1.4 En déduire quelle est l'espèce prédominante dans
la solution d'acide sulfureux préparée.
2. Concentrations en solution
2.1 Écrire l'équation de la réaction entre l'acide
sulfureux H2
SO3
et l'eau de constante d'acidité KA1�
2.2 Exprimer la constante d'acidité KA1 en fonction
des concentrations en quantité de matière des
espèces mises en jeu�
2.3 Calculer la concentration [H3
O
+
] de la solution
d'acide sulfureux de pH = 2,5�
2.4 Exprimer [HSO3
-
] en fonction de [H3
O
+
], puis
calculer cette concentration�
2.5 Déduire des questions précédentes l'expression
de [H2
SO3
] en fonction du pH et du pKA1 et calculer cette concentration 2.6 Sachant que [SO3
2-
L'acide sulfurique H2
SO4
est aussi un diacide. Sa forme
H2
SO4
est un acide fort tandis que HSO4
-
(aq) est un acide
de pKA3 = 1,9. Il s'obtient par hydratation du trioxyde de
soufre SO3
. Cet acide, que l'on considère totalement dissocié
sous la forme (2 H3O+
(aq) ; SO4
2-
(aq)), réagit avec le calcaire
CaCO3
(s) selon la réaction modélisée par :
CaCO3
(s) + 2 H3O+
(aq) $ Ca2+
(aq) + CO2
(g) + 3 H2O(l
] = 6,3 × 10-8
mol·L-1
, préciser si les valeurs de concentrations des espèces présentes en solution
confirment l'espèce prédominante prévue par le diagramme de
prédominance
3. Dégradation du calcaire
3.1 Préciser quel acide est le plus fort entre l'acide
sulfurique et l'acide sulfureux. Justifier.
3.2 Préciser à quel couple acide-base correspond le
pKA3
3.3 Calculer le volume minimal de solution aqueuse
d'acide sulfurique de pH = 3,0 pour dégrader 2g de calcaire
Bonjour Mpsi2020s et bienvenue
recopié ainsi, ton énoncé n'est pas lisible
merci de faire "aperçu" avant de poster

Effectivement désolé du coup voici le sujet le sujet :
1. Acide sulfureux
1.1 Préciser le terme permettant de qualifierHSO ( 3 aq). -
Identifier la base associée à HSO3(aq)
correspondant au deuxième couple ainsi que la
demi-équation.
À l'intersection entre les courbes rouge et verte sur le
diagramme de distribution, les concentrations des deux
espèces associées sont égales en raison de leur proportion équivalente.
1.2 À partir de ce diagramme, déterminer la valeur du
pKA2 en expliquant la démarche.
1.3 Tracer le diagramme de prédominance des trois
espèces étudiées
1.4 En déduire quelle est l'espèce prédominante dans
la solution d'acide sulfureux préparée.
2. Concentrations en solution
2.1 Écrire l'équation de la réaction entre l'acide
sulfureux H2SO3 et l'eau de constante d'acidité KA1
2.2 Exprimer la constante d'acidité KA1 en fonctiondes concentrations en quantité de matière desespèces mises en jeu
2.3 Calculer la concentration [H3O+] de la solution d'acide sulfureux de pH = 2,5
2.4 Exprimer [HSO3] en fonction de [H3O+], puis calculer cette concentration
2.5 Déduire des questions précédentes l'expression
de [H2SO3] en fonction du pH et du pKA1 et calculer cette concentration
L'acide sulfurique H2SO4
est aussi un diacide. Sa forme
H2SO4 est un acide fort tandis que HSO4-(aq) est un acide de pKA3 = 1,9. Il s'obtient par hydratation du trioxyde de
soufre SO3
. Cet acide, que l'on considère totalement dissocié sous la forme (2 H3O+(aq) ; SO42- (aq)), réagit avec le calcaire CaCO3 (s) selon la réaction modélisée par :
CaCO3(s) + 2 H3O+ (aq) = Ca2+ (aq) + CO2(g) + 3 H2O(l) , préciser si les valeurs de concentrations des espèces présentes en solution
confirment l'espèce prédominante prévue par le diagramme de
prédominance
3. Dégradation du calcaire
3.1 Préciser quel acide est le plus fort entre l'acide
sulfurique et l'acide sulfureux. Justifier.
3.2 Préciser à quel couple acide-base correspond le
pKA3
3.3 Calculer le volume minimal de solution aqueuse
d'acide sulfurique de pH = 3,0 pour dégrader 2g de calcaire
Données : • Constante d'acidité associée au couple précédent : pKA1 = 1,8
M(Ca) = 40,1 g·mol-1
et M(O) = 16,0 g·mol-1
Bonsoir,
La première chose à faire est de poster les courbes " rouge et verte "
Ensuite ...
Reprendre la partie 1 en répondant soigneusement ( pas en jetant juste un mot en pâture ) à toutes les questions posées
le diagramme est en pièce jointe
Concernant mes réponses, il est vrai que dans la mesure où je fais cet exercice pour m'entrainer et non comme un devoir je n'ai pas pris la peine de rédiger convenablement et je peux comprendre que cela puisse vous déranger.
Je vous réecris donc les réponses dont je voudrais qu'elles soient vérifiées :
2.B Ka1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
c)[H3O+] = 3.2*10^-3 mol/l
d)[HSO3-]=[H3O+] = 3.2*10^-3 mol/l
e)H2SO3]eq=([H3O+]eq*[HSO3-]eq)/-log(pKa1)=6.3*10^-4 mol/L
Pour la 3.3 je fais un tableau d'avancement mais je trouve soit 20 L soit 40 L ce qui est beaucoup trop
2.B Ka1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
c)[H3O+] = 10-pH=10-2.5/sup]3.2*10^-3 mol/l
d)D'après la stoechiométrie de l'équation, on a : [HSO3-]=[H3O+] = 3.2*10^-3 mol/l
e)D'après 2.B., on a Ka1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
<=> 10[sup]-pKa1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
H2SO3]eq=([H3O+]eq*[HSO3-]eq)/10-pka1=6.5*10^-4 mol/L
Pour la 3.3 je fais un tableau d'avancement mais je trouve soit 20 L soit 40 L ce qui est beaucoup trop.
Si vous trouvez que c'est toujours pas assez rédigé pouvez vous au moins me donner des pistes pour la 3.3
2.B Ka1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
c)[H3O+] = 10-pH=10-2.5/sup]3.2*10^-3 mol/l
d)D'après la stoechiométrie de l'équation, on a : [HSO3-]=[H3O+] = 3.2*10^-3 mol/l
e)D'après 2.B., on a Ka1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
<=> 10[sup]-pKa1=([H3O+]eq*[HSO3-]eq)/[H2SO3]eq
H2SO3]eq=([H3O+]eq*[HSO3-]eq)/10-pka1=6.5*10^-4 mol/L
Oui, ces résultats sont exacts.
Question 3.3 :
L'emploi d'un tableau d'avancement, même s'il n'est pas ici indispensable ici, est une bonne idée.
Je ne peux pas savoir pour quelle raison ton résultat ne convient pas tant que tu n'exposes pas le détail de ton calcul



