Inscription / Connexion Nouveau Sujet
Suivi transformation chimique
Bonjour à tous, j'espère que vous allez bien. J'ai un exercice sur la vitesse volumique de disparition auquel je suis bloqué à une question , voici l'énoncé :
L'étude cinétique de l'hydrolyse du 2-chloro-2-méthylpropane pour former un dissolvant à peinture, le ter-butanol, se fait sur un mélange initial de (CH3)3C-CL à la concentration C0 = 0.100mol.L-1 en eau-propanone avec une grande quantité d'eau. On détermine au cours du temps, les concentrations C en 2-chloro-2-méthylpropane et l'on cherche à savoir si les conditions de l'expérience vont permettre une synthèse rapide du dissolvant.
Le tert-butanol est utilisé dans la restauration des toiles de maître comme solvant vert en remplacement du diméthyle formamide, un composé très toxique.
On a ce tableau de données :
| C(mol.L-1) | 0.10 | 0.085 | 0.075 | 0.066 | 0.057 | 0.048 | 0.042 | 0.036 |
| t(h) | 0.0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 6.0 | 7.0 |
1) A l'aide de la courbe C(t), démontrer que la concentration en 2-chloro-propane suit une loi de vitesse d'ordre 1.
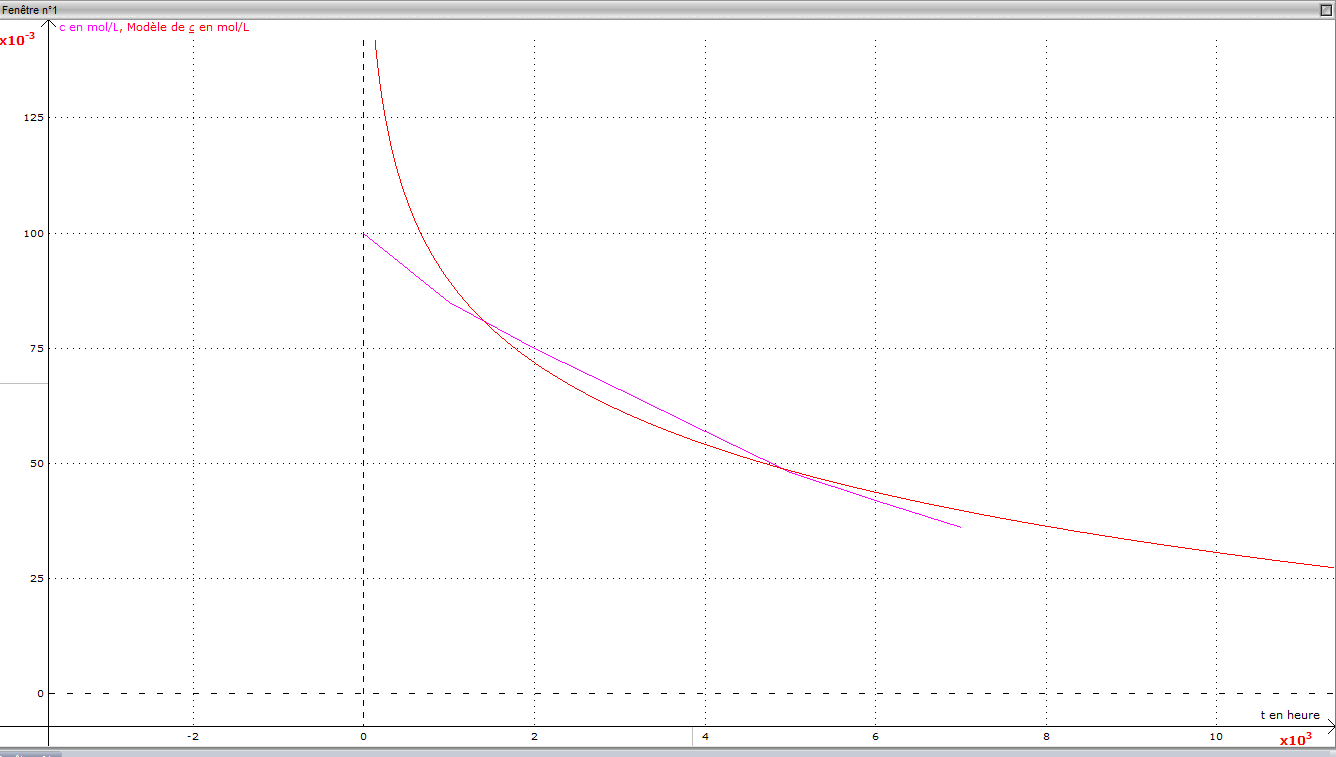
Pour cette question, j'ai tracé la courbe en rose avec Latis-pro. On remarque que la réaction suite une loi de vitesse d'ordre 1 car l'évolution évolue proportionnellement au temps, on remarque une fonction linéaire.
2) Calculer la constante de vitesse k à l'aide de la courbe Ln(C(t)) et en déduire le temps de demi-réaction t1/2.
Pour cette question, j'ai tracer la courbe log népérien sur ma courbe ( avec le logiciel en rouge). Je suis bloqué à cette question, je ne vois pas comment trouver k... Est-ce possible d'avoir un coup de main svp ?
3) L'état final d'une transformation chimique est atteint au bout d'une durée allant de 5 à 10 fois le temps de demi-réaction. Estimer si la transformation est terminée au bout de 10h.
4) Citer les moyens de l'accélérer.
Merci à vous

Bonjour
Si la cinétique est d'ordre un, la concentration évolue exponentiellement en fonction du temps, pas linéairement. C'est le logarithme neperien de la concentration qui est fonction affine du temps.
vanoise
Ah excusez-moi... Je viens de commencer le chapitre...
Et pour le log népérien, ici il n'est pas linéaire ou alors je l'ai mal fait mais ça ma semblé bizarre aussi.
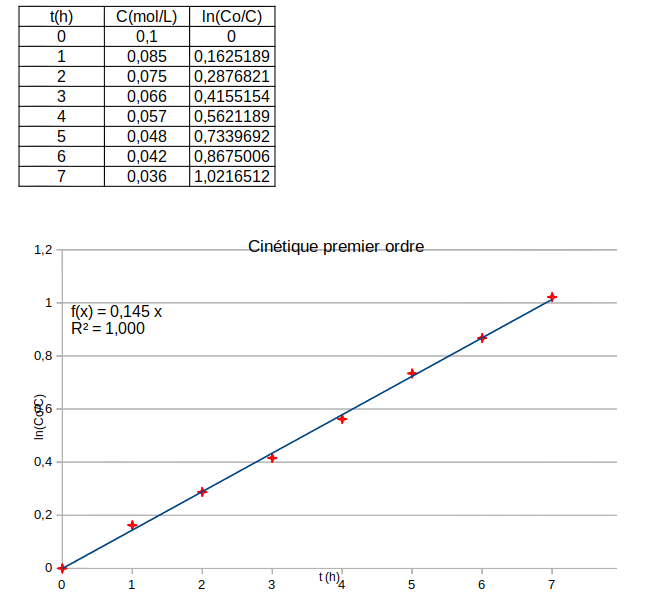
J'ai représenté ln(Co/C) en fonction de t, histoire d'avoir une droite passant par l'origine du repère. Aucun problème : les points sont très bien (presque trop bien...) alignés le long d'une droite moyenne dont le logiciel fournit l'équation.
Je comprends pas pourquoi ln(). C'est une formule de cours ou c'est la formule ln ? J'ai pas encore vu les ln c'est pour ça
J'ai pas encore vu les ln c'est pour ça
Relis la question 2 de l'énoncé : il y est question de logarithme...
Ce problème est posé par ton professeur ? Sa résolution au niveau terminale me parait bien délicate sans un minimum de connaissances sur les exponentielles et les logarithmes...
Je te fournis la méthode ; à toi d'approfondir cela avec ton cours de math.
Pour une cinétique du premier ordre avec ces conditions initiales :
Si on représente graphiquement les variations du logarithme de (Co/C) en fonction de t, on obtient théoriquement un ensemble de points expérimentaux sensiblement alignés le long d'une droite passant par l'origine du repère et de coefficient directeur k.
Ah d'accord.
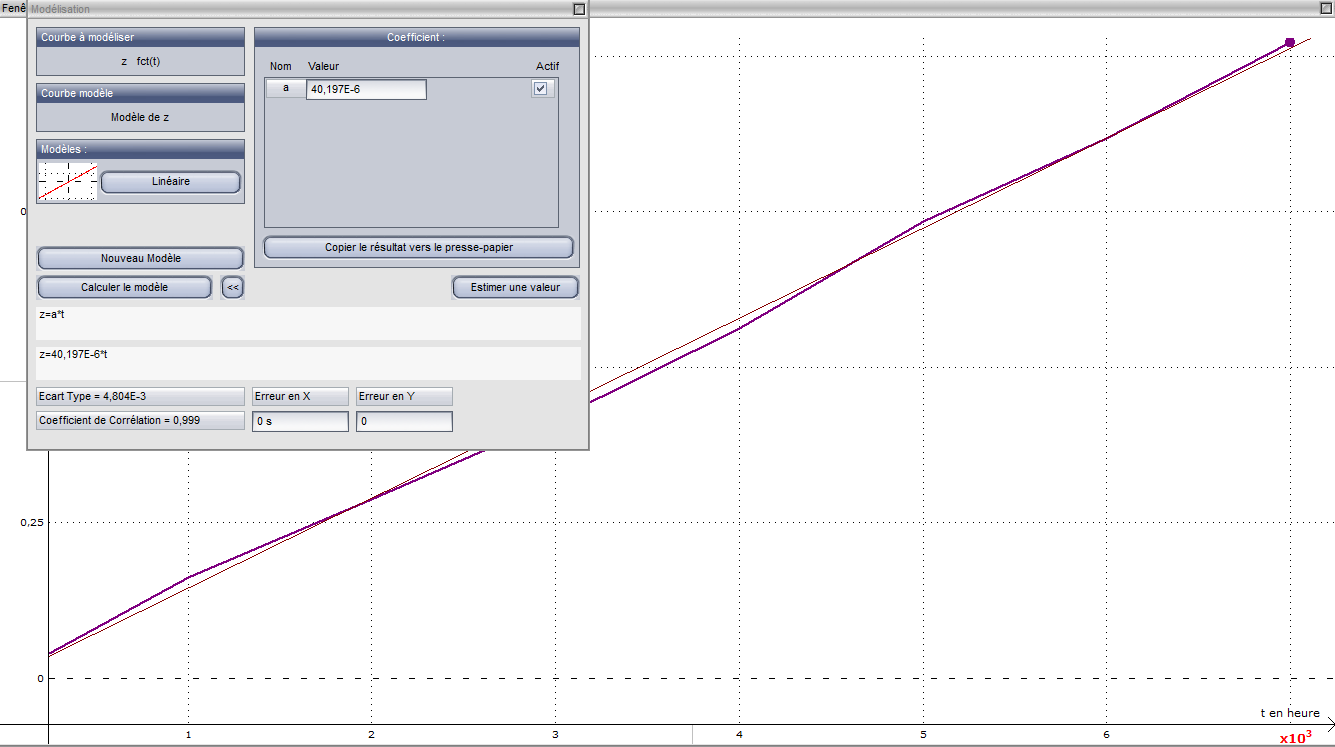
Sinon, j'ai fais comme vous pour le graphique( je l'ai fais sur latis-pro) mais je trouve pas la même valeur de x, je trouve f(x)=40,197.10-6x.
C'est correct ou pas ?
J'ai pas encore vu les ln c'est pour ça
Relis la question 2 de l'énoncé : il y est question de logarithme...
Ce problème est posé par ton professeur ?
Oui il est posé par mon professeur mais l'énoncé indique de trouver à l'aide de la courbe.
Pour le temps de demi- réaction je prends cette courbe( la droite qui modélise la courbe) on est d'accord ?
C'est correct ou pas ?
J'ai laissé t mesuré en heures. Si tu convertis les heures en secondes, tu vas obtenir un coefficient directeur 3600 fois plus petit...
Utilise la méthode préconisée par ton professeur.
Maintenant : que vaut ln(Co/C) si t=t1/2 ?
Donc : que vaut k.t1/2 ?
Ah oui en effet, j'ai refais mon graphique en h et je trouves x = 0.145 donc k = 0.145x. Si t = 1/2 alors In(Co/C) vaut 508,42.10-3 environ.
Mais nous on veut le temps de demi-réaction non ?
Très simplement : pour t=t1/2 : C=Co/2 ; donc :
k.t1/2=ln(2)=0,693...
Connaissant k, facile d'en déduire t1/2.
J'ai pas encore vu les ln...
Pour le temps de demie réaction on peut pas le faire graphiquement ?
Parce que je comprends pas votre formule
L'énoncé demabde d'utiliser les logarithmes pour obtenir t1/2 mais, comme déjà écrit, cet énoncé ne correspond pas vraiment au programme de terminale.
Par la méthode demandée :
t1/2=ln(2)/k=0,693/0,145=4,78h
Sinon, tu peux obtenir un bon ordre de grandeur de t1/2 en repérant la valeur de t correspondant à C=Co/2=0,05mol/L.
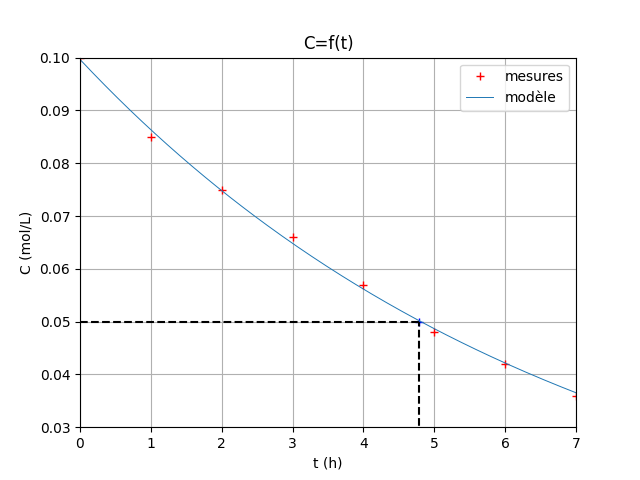
D'accord merci beaucoup, de mon côté je trouve 4.79h environ...
Après pour les autres questions je vais me débrouiller,
L'intervalle sera de [5*4.79;10*4.79]
et ensuite dernière question :
- température + élevée
-ajout d'une catalyse
- +grosse concentration de 2-chloro-propane
Merci beaucoup pour votre aide, j'ai bien compris, il me reste à voir les ln et c'est bon. Je me demande en contrôle je suis censé faire comment car je n'ai pas encore vu ça...
Très bonne fin d'après midi à vous !


