Inscription / Connexion Nouveau Sujet
spectrophotométrie type bac
Bonsoir
Pouvez-vous m'aider pour cet exercice de type bac, juste me donner des pistes parce que je bloque On vient de commencer le chapitre.
On vient de commencer le chapitre.
1.Choix de la méthode de suivi
1.1. L'ion dichromate ainsi que l'ion chrome (III) colorent la solution. Cette coloration de la solution va
donc changer en fonction de l'apparition des ions chrome (III) et/ou la disparition des ions chromate. La
réaction pourra donc être suivie par spectrophotométrie.
1.2. La spectrophotométrie est une méthode de mesure non-destructive car le système chimique n'est
pas modifié par le passage de la lumière au cours de la mesure.
2. Suivi temporel
2.1. On sélectionne la longueur d'onde qui correspond au maximum d'absorption de l'espèce chimique
étudiée
|
Espèces chimique | CH3CH2OH | Cr2O72- | Cr3+ | CH3COOH |
| Couleur en solution
aqueuse | incolore | jaune orangé | vert | incolore |
1. Choix de la méthode de suivi.
1.1. Expliquer pourquoi cette réaction chimique peut être suivie par spectrophotométrie.
1.2. Pourquoi cette méthode peut-elle être qualifiée de « non-destructive » ?
2. Suivi temporel.
On désire suivre la présence des ions dichromate Cr2O72-
On réalise les réglages préalables de l'appareil :
- on sélectionne la longueur d'onde λ = 420 nm ;
- on réalise « le blanc » avec une solution aqueuse contenant l'ion chrome Cr3+
. Les ions
dichromate et chrome n'absorbent pas dans le même domaine de longueur d'onde.
À la date t = 0, on mélange 2,0 mL de sang prélevé au bras d'un conducteur avec 10,0 mL
d'une solution aqueuse acidifiée de dichromate de potassium (2K+
+ Cr2O72-) de concentration
molaire c = [Cr2O72-] = 2,0.102-mol.L-1
Le volume total du mélange réactionnel est V = 12,0 mL.
On agite et on place rapidement un prélèvement du mélange réactionnel dans une cuve du
spectrophotomètre.
Le prélèvement dans la cuve évolue de la même façon que le mélange réactionnel.
Le spectrophotomètre est connecté à un ordinateur, il mesure l'absorbance A du mélange
réactionnel au cours du temps.
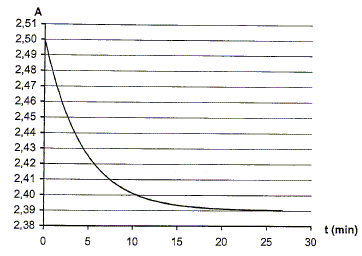
On obtient l'enregistrement page suivante.
voir image ci-dessous
2.1. D'une manière générale, sur quel critère sélectionne-t-on la longueur d'onde pour effectuer
un suivi spectrophotométrique ?
2.2. Établir le tableau d'avancement du système en désignant par n0 la quantité de matière
initiale d'alcool présente dans les 2,0 mL de sang, et par n1 la quantité de matière initiale en ions
dichromate introduite dans le mélange réactionnel.
N.B. : dans les conditions de l'expérience, l'ion H+
est en excès. On ne renseignera donc pas la
colonne relative à cet ion dans le tableau d'avancement.
2.3. Quelle relation existe entre l'avancement x de la réaction, la concentration en ions
dichromate [Cr2O72-] dans le mélange, le volume V du mélange réactionnel, et la quantité n1 ?
2.4. L'absorbance A est liée à la concentration [Cr2O72-] (en mol.L-1) par la relation :
A = 150 [Cr2O72-] (pour λ = 420 nm)
Déduire de la relation établie en 2.3. que l'avancement x est lié à l'absorbance A par la relation :
x = (10 - 4.A).10-5(mol)
2.5. La réaction peut être considérée comme totale. À l'aide du graphique A = f(t), calculer
l'avancement maximal. En déduire que le réactif limitant est l'éthanol.
2.6. Le taux autorisé d'alcool est de 0,5 g dans 1 L de sang.
Le conducteur est-il en infraction ?
Ce que j'ai fais:
Je n'arrive pas la question 1) 1.1 et 1.2
je n'arrive pas aussi la question 2.1.
La question 2.2 réussi
2.3:
Concentration (mol/L)=(quantité de matière (mol))/(volume (L))
[Cr2O72- aq]=(n(Cr2O72-))/V=(n1-2x)/V
2.4 A=150*[Cr2O72-]
[Cr2O72-]=(A)/(150)
(n1-2x)/(V)=A/150
Après je bloque

Merci d'avance
Bonne soirée