Inscription / Connexion Nouveau Sujet
Spectrophotométrie
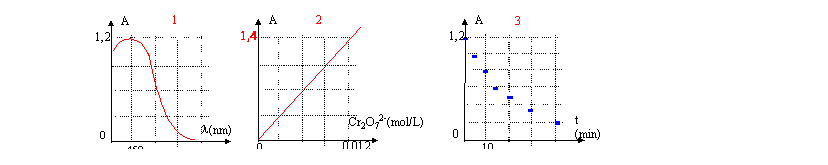
L'absorbance est proportionnelle à la concentration en ion dichromate ( figure 2) ; déterminer le coefficient directeur de la droite : ce coefficient vaut : 1,4 / 0,012 = 116,7 L mol-1.
A= 116,7 [Cr2O72- ] ou [Cr2O72- ] = 8,7 10-3 A
je ne comprend pas pourquoi on ecris que c'est aussi égale a 8,7x 1o^-3
quelqu'un pourrait t il m'éclairer?
 L'ion dichromate Cr2O72- est l'oxydant du couple Cr2O72- / Cr3+. L'acide oxalique est le réducteur C2H2O4 du couple C2H2O4 / CO2.
L'ion dichromate Cr2O72- est l'oxydant du couple Cr2O72- / Cr3+. L'acide oxalique est le réducteur C2H2O4 du couple C2H2O4 / CO2.
Ecrire l'équation de la réaction d'oxydo réduction qui se produit entre l'ion dichromate et l'acide oxalique en milieuu acide.
On suit l'évolution de la réaction par spectrophotométrie.
- A quelle longueur d'onde faut-il se placer ( figure 1) pour déterminer le plus précicémment possible la concentration des ions dichromate ? Justifier.
- Justifier la couleur orangé de la solution.
Justifier l'utilité du graphe n°2.
- Déterminer l'équation A = f([Cr2O72- ]
A t=0 on réalise le mélange suivant :
- v1 =10 mL acide oxalique à C1 = 0,4 mol/L ;
- v2 = 10 mL solution acidifiée dichromate de potassium à C2 = 0,02 mol/L
On agite et on place une partie du mélange dans une cuve dans un spectrophotomètre. On relève l'absorbance ( figure 3). Déduire de la courbe A=f(t) la représentation graphique de [Cr2O72- ] = f(t)
Dresser le tableau d'évolution du système.
Montrer que l'avancement x est relié à l'absorbance A par la formule : x = (0,2-A/6) 10-3.
- Calculer x pour différentes valeurs et tracer la courbe x= f(t).
- Trouver le réactif limitant et déterminer le temps de demi réaction en supposant la réaction totale.
pour R-Cl : masse molaire = 92,6 g/mol ; densité d= 0,85.
Bonjour j'ai le même exercice a faire seulement je ne comprend pas grand chose quelqu'un pourrait m'aider ?

 8,7.10^-3.A
8,7.10^-3.A
