Inscription / Connexion Nouveau Sujet
solutions colorés et absorbance
bonjour
j'ai un petit dm pour la rentrée composée de plusieurs exos je vous en montre un pouvez vous m'aider ?
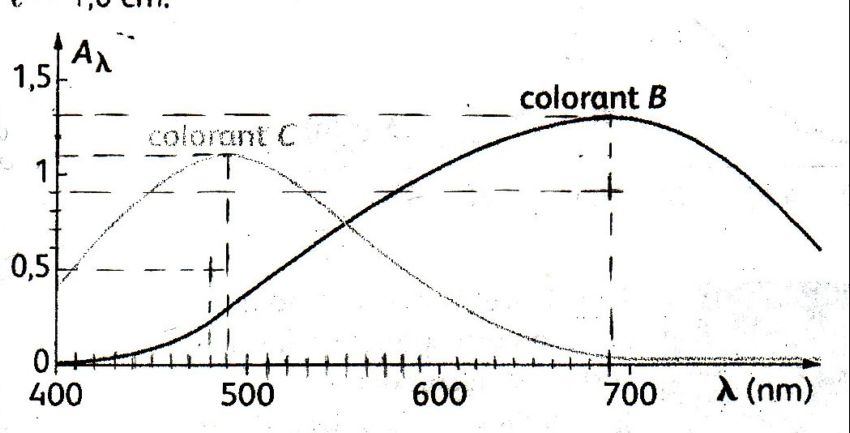
la figure ci-dessous représente les spectres d'absorption d'un colorant B et d'un colorant C tous deux à la concentration C=1,5x10-3mol/l
et relevés dans une cuve de largeur l=1,0 cm
une solution aqueuse S contient un mélange du colorant B à la concentration molaire Cb et du colorant C à la concentration Cc
on mesure l'absorbance de la solution à 2 longueurs d'onde différentes :
A480=0.50 et A690=0.90
déterminer la concentration Cb du colorant B puis la concentration Cc du colorant C
merci d'avance
bonjour
expression de la loi de Beer Lambert
A= *l*C
*l*C
 dépendant de la nature de la solution et de la longueur d'onde.
dépendant de la nature de la solution et de la longueur d'onde.
remplaçons  *l par K
*l par K
alors
A=K*C
Pour 480nm ,notons KB et KC le facteur K pour les solutions B et C
graphiquement ,pour la concentration C=1,5.10-3,on peut lire les absorbances AB et AC des solutions B et C
on peut écrire
AB=KB*C d'où KB=....(soit on le calcule avec la valeur de C connue ,soit on l'exprime en fonction de C)
AC=KC*C d'où Kc=....(soit on le calcule avec la valeur de C connue ,soit on l'exprime en fonction de C)
Pour 690nm ,notons K'B et K'C le facteur K pour les solutions B et C
graphiquement ,pour la concentration C=1,5.10-3,on peut lire les absorbances A'B et A'C des solutions B et C
on peut écrire
A'B=K'B*C d'où K'B=....(soit on le calcule avec la valeur de C connue ,soit on l'exprime en fonction de C)
A'C=K'C*C d'où K'c=....(soit on le calcule avec la valeur de C connue ,soit on l'exprime en fonction de C)
tout cela a permis de calculer les coefficients KC,KB,K'B,K'C
Dans le mélange ,les solutions B et C sont aux concentrations Cb et Cc (inconnues)
Pour chaque longueur d'onde utilisée,l'absorbance du mélange est la somme des absorbances de chaque solution
à 480nm
A(M)= KB*Cb + KC*Cc (1)
les seules inconnues sont Cb et Cc
à 690nm
A'(M) =K'B*Cb + K'C *Cc (2)
les seules inconnues sont Cb et Cc
(1) et (2) forment un système d'équations à résoudre ,pour trouver Cb et Cc
je trouve le système suivant
A(M)=133.3*Cb+733.3*Cc
A'(M)866.7*Cb+66.7*Cc
mais je n'arrive pas à résoudre ce système
je n'ai pas vérifié tes calculs ,mais pour résoudre le système il faut utiliser les valeurs de A(M)et A'(M) données dans l'énoncé , c'est à dire 0,5 et 0,9.
Ensuite ,tu exprimes ,par exemple,Cb en fonction de Cc dans la première équation et tu reportes cette expression dans la seconde équation .
Tu auras donc une équation à une inconnue (Cc)
merci beaucoup je viens de comprendre
je pense que j'aurais des problèmes de rédaction car c'est assez long
merci encore
les valeurs trouvées pour Kb Kc K'B,K'C sont valables.
je trouve,en arrondissant:
Cb= 1,0.10-3mol/L
Cc=5,0.10-4 mol/L
Bonsoir Coriolan, je pense que vous avez commis une erreur quelque part, car je n'ai pas trouvé la même valeur pour Cb , soit 6,8*10-4 mol/L
Refaites votre calcul 
Bonsoir,
J'ai pu me tromper ,mais il serait préférable que tu détailles ton calcul avant de me demander de refaire le mien 
Je reconnaîtrais sans problème mon erreur si c'est le cas
Excusez-moi, je voulais dire pour le colorant C. Voici ma démonstration:
Afin de déterminer la concentration Cc du colorant C, on va utiliser la loi de Beer-Lambert, soit A=E(lambda)*l*c
c=A/ (E(lambda)*l)
c= 0,50 / (733*1)
c= 6,8*10-4
Allez, bonne soirée! 
bonjour,
il faut trouver les concentrations Cc et Cb dans le mélange,donc résoudre
je trouve le système suivant
A(M)=133.3*Cb+733.3*Cc
A'(M)=866.7*Cb+66.7*Cc
Les valeurs de Kb,Kc,K'b,K'c, dépendent de la précision de lecture du graphique.
En refaisant des mesures,je trouve confirme les valeurs 133,3 et 733,3 de la première équation.
Pour la seconde ,à 780 nm=,je trouve A(b)=0,05 soit K'C= 0,05/1,5.10-3=33,3 le système à résoudre est alors
je trouve le système suivant
0,5=133.3*Cb+733.3*Cc
0,9=866.7*Cb+33,3*Cc
Cela ne modifie pas les résultats trouvés ,soit Cb= 1,0.10-3mol/L
Cc=5,0.10-4 mol/L
***Message en doublon supprimé***



