Inscription / Connexion Nouveau Sujet
Solution de nitrate de calcium
Pour un DM de physique chimie, j'ai un exercice de chimie qui me pose problème à qq questions.
Voici l'énoncé :
1. Quelle masse de nitrate de calcium tétrahydraté Ca(NO3)2,4H2O faut-il dissoudre pour obtenir une solution S0 de volume V0=500 mL de solution de concentration molaire C0= 1,00.10-2 mol.L-1
A cette question, j'ai trouvé 1.18 grammes.
2. Quelles sont les concentrations molaires des ions présents dans la solution S0 ?
Pour cette question je ne suis pas certaine de la réponse, j'ai trouvé [Ca2+]= 0,01 mol.L-1 et [NO3-] = 0,02 mol.L-1.
J'ai procédé avec un tableau d'avancement pour trouver ces valeurs, mais je ne suis pas certaine de ma méthode...
3. On prépare à partir d'un volume Vi de cette solution S0, cinq solutions filles Si de volume V = 100 mL. Compléter le tableau suivant :
| Solution | S0 | S1 | S2 | S3 | S4 | S5 |
| Vi (mL) | 100 | 80 | 60 | 40 | 20 | 10 |
| Veau (mL) | 0 | 20 | 40 | 60 | 80 | 90 |
| Ci (mol.L-1) | ... | ... | ... | ... | ... | ... |
Mon problème est les concentrations. Quand je calcule, je pars d'une concentration 5,0.10-3 pour S0 et une concentration de 2,5.10-2 pour S5, donc une concentration qui augmente... Pour moi c'est illogique et c'est là mon grand besoin d'aide svp :s
Merci d'avance
Bonjour,
Commençons par le début...
La première question, comment as-tu fait pour trouver 1,18 g ?
Pour la deuxième question, c'est correct mis à part les chiffres significatifs. Il n'est pas nécessaire d'utiliser un tableau d'avancement pour trouver ça !
Bonjour,
Pour la première question, j'ai calculer la quantité de matière : n = C x V
Je trouve 5,0.10-3 mol
J'ai ensuite enchaîner avec la formule suivante :
m = M x n
m = MCa(NO[sub]3),4H20[/sub] x n
m = (MCa + 2MN + 6MO + 8MH + 4MO) x n
m = (40,1 + 2x14,0 + 6x16,0 + 8x1,0 + 4x16,0) x 5,0.10-3
m = 1.18 gr
OK, parfait...
Pour la 2, puisqu'on a Ca(NO3)2, pour une concentration de 1,00.10-2 mol.L-1, on a :
- la même concentration pour Ca2+ ==> 1,00.10-2 mol.L-1
- pour NO3-, on a 2 NO3- pour un Ca2+ ==> 2,00.10-2 mol.L-1
Pour la 3
Pour la solution S0, c'est la même concentration ==> 1,00.10-2 mol.L-1
Pour S1, on a 80 mL à 1,00.10-2 mol.L-1. On ajoute 20 mL d'eau, ce qui donne 100 mL. Il ne reste plus qu'à appliquer C1V1 = C2V2
1,00.10-2  80.10-3 = C2
80.10-3 = C2  100.10-3
100.10-3
C2 = (1,00.10-2  80.10-3) / 100.10-3
80.10-3) / 100.10-3
C2 = (1,00.10-2  8) / 10
8) / 10
C2 = 0,80.10-2 mol.L-1
Tu appliques le même principe pour les autres...
Merci beaucoup !
j'ai pourtant appliqué cette formule, CxV, mais j'ai du m*rd*r quelque part...
Pouvez-vous m'aider encore un peu s'il vous plaît :s ?
Car je n'ai posté que le début de l'exercice, ce qui me posait réellement problème et en continuant je me suis aperçue qu'il y avait encore la dernière question...
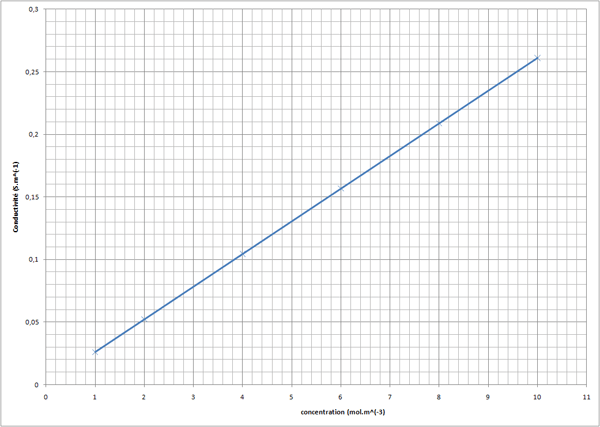
On me demande de tracer un graphique,  = fCi, facile, et d'en déduire la conductivité molaire (le grand V à l'envers que je n'ai pas trouvé) du soluté. On me demande de faire attention au unités mais justement ça je ne comprend pas.. Je ne sais pas pour les unité ni comment déduire la conductivité ..
= fCi, facile, et d'en déduire la conductivité molaire (le grand V à l'envers que je n'ai pas trouvé) du soluté. On me demande de faire attention au unités mais justement ça je ne comprend pas.. Je ne sais pas pour les unité ni comment déduire la conductivité ..
Ensuite :
Les conductivités molaires ioniques des ions calcium et nitrate valent respectivement :
 Ca2+ = 1,19 mS.m2.mol-1 et
Ca2+ = 1,19 mS.m2.mol-1 et  NO[sub]3-[/sub] = 7,1 mS.m2.mol-1
NO[sub]3-[/sub] = 7,1 mS.m2.mol-1
Parmis les expressions suivantes proposées pour la conductivité molaire Lambda majuscule, choisir la bonne réponse et proposer une interprétation :
a. Grand Lambda =  Ca2+ +
Ca2+ +  NO[sub]3-[/sub]
NO[sub]3-[/sub]
b. Grand Lambda =  Ca2+ + 2
Ca2+ + 2 NO[sub]3-[/sub]
NO[sub]3-[/sub]
c. Grand Lambda = 2 Ca2+ +
Ca2+ +  NO[sub]3-[/sub]
NO[sub]3-[/sub]
Comment choisir et comment interprêter ?? Là c'est l'équivalent de chiois pour moi ...
Merci d'avance, et je vous remercie encore pour votre réponse précédente qui m'aide beaucoup.
Pour la conductivité molaire ("le grand V à l'envers"), il faut utiliser LaTeX . Pour cela, il suffit de sélectionner le texte avec la souris par un clic gauche, de cliquer sur l'icône LTX sous le cadre de réponse quand le texte est sélectionné et le texte est \Lambda .(Voir l'image jointe pour l'aspect définitif).
Et on obtient .
Je te réponds un peu plus tard pour le reste.

Si on dit de faire attention aux unités, c'est parce que habituellement la concentration c est exprimée en mol.L-1.
La conductivité molaire est égale à :
D'où pour les unités :
veut dire "unité de
" mais je ne sais pas si cette notation est toujours utilisée...
Donc, "faire attention aux unités" signifie qu'il faut mettre c en mol.m-3 et non pas en mol.L-1.
Parmi les expressions suivantes proposées pour la conductivité molaire
a.
b.
c.
Si on prend
Donc la bonne proposition est la b.
La conductivité molaire est la conductivité lorsque la concentration est égale à 1 mol.m-3.
Donc, pour une concentration de 1 mol.L-1 de Ca(NO3)2, la concentration en Ca2+ est 1 mol.L-1 et la concentration en NO3- est 2 mol.L-1.
Donc la conductivité :
D'où la conductivité molaire
Merci de votre patience et de vos réponses. Maintenant je comprend mieux !
Encore une fois merci
Ephystillia