Inscription / Connexion Nouveau Sujet
Solution aqueuse de Chlorure d'ammonium
Bonsoir, j'aurai un petit problème au niveau des résolutions de certaines questions.
Une solution aqueuse de chlorure d'amonium NH4+ + Cl- de concentration en solute apporte c=1,0x10^(-2) mol/L a un pH de 5,6.
a. L'ion ammonium est la forme acide d'un couple acide-base. Quelle est la forme basique de ce couple? NH4+/NH3 Acide/Base
b. Ecrire l'equation de la reaction de l'ion ammonium avec l'eau: NH4+ + H2O = NH3 + H3O+
c. Donner l'expression de la constante d'equilibre K pour b: K= [NH3].[H30+]/[NH4+]
d. K= 6.3x10^(-10), determiner la valeur du rapport [forme basique]f/[forme acide]f dans l'etat final du systeme constitue par la solution edudiee pour le couple en a. C'est la que je ne comprends pas. Est ce Qr = [NH3]/[NH4+] ? Que fait il faire ? Calculer [NH3]=10^-PH ?
e. Quelle est la relation entre l'avancement final et la quantite de matiere d'ammoniac a l'etat final? Même question dois-je faire un tableau d'avancement ?
f. Determiner le taux d'avancement final de la reaction de l'ion ammonium avec l'eau pour 1,0 L de solution.
g. Calculer la valeur de quotient de reaction Qr, pour l'equation ecrite en b pour un etat inital du systeme tel que [NH3]i = [H3O+]=3.0x10^(-4) mol/L et [NH4+]i=5.0x10^(-2) mol/L. Le systeme est-il a l'equilibre dans ces conditions?
d) K est la valeur de Qr lorsque l'équilibre est atteint.
Qr et K ont la même expression mais ,dans le cas de K,les valeurs des concentrations sont celles des réactifs et des produits lorsque l'équilibre est atteint
à l'équilibre (c'est à dire à l'état final) , K/[H3O+]=[NH3]/[NH4+]
Puisque tu connais le pH,tu peux calculer [H3O+]
e)tu peux faire un tableau d'avancement
g)fais le calcul de Qr avec les valeurs fournies ,et compare avec K
Si Qr=K le système est à l'équilibre
si Qr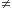 K le système n'est pas à l'équilibre .
K le système n'est pas à l'équilibre .
Deux cas envisageables
Qr<K la réaction va évoluer dans le sens de la formation des produits.
Qr>K la réaction va évoluer dans le sens de la diminution des produits



