Inscription / Connexion Nouveau Sujet
Solubilité dans l'eau
Salut,
Je ne comprends pas bien cette question
"
Lequel des sels suivants possède la solubilité la plus petite ?
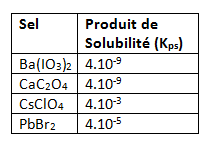
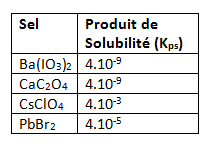
Tableau ici.
J'ai les choix suivants :
Choix 1
Ba(IO3)2
Choix 2
CaC2O4
Choix 3
CsClO4
Choix 4
PbBr2
"
Je dirai déjà que le moins soluble c'est celui qui a la valeur Ksp la plus faible (donc la plus grande puissance négative et le chiffre en dessous (je sais plus le nom en mathématique ^^) le plus haut , mais comme c'est négatif 0,9 sera tjrs plus faible que 0 ,1...) :
EN faisant la racine du Ksp on a , ile me semble, la concentration en mol/L...
Donc celui atteint le plus facilement la saturation je me suis dis que c'est les deux première molécules de sel avec une puissance négative 10^-9 multiplié par 4.
Mais je n'arrivais pas à savoir pourquoi c'était plus la molécule la moins soluble :
Ba(IO3)2
Et pas la molécule :CaC2O4
Est ce parce que le nombre d'atomes de la deuxième molécule est plus nombreuse que la première ?
Merci
Bonjour
Je dirai déjà que le moins soluble c'est celui qui a la valeur Ksp la plus faible
Cela n'est vrai que si les différents solides passe en solution en libérant les mêmes quantités d'ions par mole de solide.
EN faisant la racine du Ksp on a , ile me semble, la concentration en mol/L...
Si la dissolution d'une mole de solide libère en solution une mole d'ions positif et une mole d'ions négatif, tu as effectivement Kps = s2 où s désigne la solubilité c'est à dire la quantité maximale de composé ionique dissoute par litre ; mais cela n'est pas toujours le cas ici.
Tu dois écrire dans chaque cas l'équation de la dissolution. Tu verras que dans certains cas : Kps = 4s3. D'autres situations sont aussi possibles...
Attention au vocabulaire : les composés ioniques ne sont pas des molécules....



