Inscription / Connexion Nouveau Sujet
Résolution prblm : transformation chimique +tableau d'avancement
Bonjour, j'ai cet exercice mais sous forme de problème et je ne sais absolument pas par où commencer :
-On se propose d'étudier une réaction faisant intervenir le diiode I2, pouvant elle aussi, être suivie pas spectrophotometrie. La réaction en question est lente de décomposition de le l'eau oxygénée H2O2 par les ions iodure I- en présence d'acide sulfurique.
-equation de réaction:
H2O2+2l-+2H+->I2+2H2O
- A la date t=0 on réalise le mélange dans un bêcher :
-V1=2,0 mL de S1 d'iodure de potassium de c 1 inconnue
-V2=20,0mL de S2 d'eau oxygénée de c2=0,10 mol. L-1
-V3=8,0mL de solution aq d'acide sulfurique concentrée contenant des ions H+ en excès
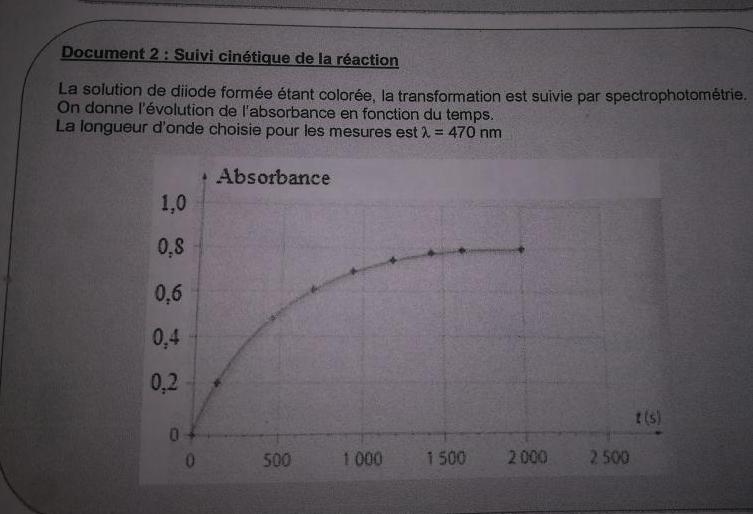
-La sol diiode étant colorée la transformation est suivie par specthophotometrie. La longueur d'onde choisie pour les mesures est y=470nm
-On a un graphique
-à la longueur y=470nm. A470=f(C(I2))
L'équation de cette droite est : A470=519 C ( I2)
Peut-on retrouver la concentration C1 de la solution S1 d'iodure de potassium ? Si oui que vaut-elle ?
Bonsoir,
Et si tu recopiais entièrement ton énoncé d'exercice ?
Par exemple en postant le graphique en question ?

Tu as plein d'exercices similaires qui pourraient t'aider à démarrer, par exemple ici :
![]() Suivi cinétique par spéctrophotométrie
Suivi cinétique par spéctrophotométrie

Ah, merci beaucoup je ne savais pas comment chercher un sujet, je vais aller voir. Si d'autres personnes ont d'autres idées je suis prenneuse. Merci encore 😊