Inscription / Connexion Nouveau Sujet
Redox
Je bloque sur la 3ème question, pourtant très basique mais je n'arrive pas à trouver le truc
Fe + Cu 2+ = Cu + Fe2+
K = 1.1026
On trempe une lame de fer dans une solution aqueuse contenant les ions cuivre à la concentration de 0.1 mol/L et les ions fer II à la concentration de 1 mol/L.
1) Calculer le quotient de réaction.
Qr = 10
2) En déduire le sens d'évolution spontanée de la réaction
Sens direct
3) Que valent les concentration des ions à l'équilibre ?
Salut, vu la constante particulièrement gigantesque, il serait correcte de considérer en première approximation que tout le Cu2+ s'est transformé en Fe2+
On aurait ainsi, [Fe2+]~~1.1 mol/L et [Cu2+]~~0 mol/L
Si l'on veut bien faire les choses (c'est certainement ça qui est attendu), il faudrait écrire le tableau d'avancement en concentration avec un x pour l'avancement.
et écrire K=[Fe2+]eq/[Cu2+]eq= on remplace par les expressions des concentrations en fonction de x à l'équilibre puis on obtient une équation du second degré en x que l'on résout.... etc... etc
Tu vois ce que je veux dire ?
Déjà je ne saisie pas bien pourquoi on parle d'équilibre ? Vu qu'on est dans le cas d'une réaction totale.
Ensuite je ne saisie pas bien pourquoi on prend les concentration à l'état final alors que le K on doit le calculer en fonction des concentrations à l'équilibre.
Sinon pour la justification avec le tableau d'avancement j'ai :
K = [Fe2+]i + x/V / [Cu2+]i - x/V
Alors :
-En effet grossièrement la réaction est totale puisque il va rester une quantité infime de Cu2+ en pratique vu la valeur de la constante.
Mais je pense que tu as vu plus d'une fois qu'en physique on écrit parfois "environ égal" ou carrément "égal" à 0 par exemple mais qu'en réalité, si l'on regarde avec une énorme loupe, contrairement aux maths où on travaille en valeurs exactes, le 0 ne sera jamais un vrai 0 mathématique mais un 10^-(un truc grand) qui pourra être négligé très souvent bien entendu.
Ainsi ici, l'énoncé veut te faire calculer proprement cette valeur très petite 10^-(qq chose) pour te faire dire un truc bateau du genre "ah c'est très petit, on va pouvoir le négliger..." ^^
(sinon, ce serait pas drôle l'exercice ferait une ligne)
-Quelle différence vois tu entre un "état final" et un "état d'équilibre" ? car dans mon esprit c'était la même chose...
-ton équation est juste, mis à part qu'il ne faut pas s'encombrer avec le V que tu ne connais pas dans cet exo. On dira que x est un avancement non pas en mol mais en mol/L (en vrai on ne devrait pas faire de tableaux d'avancements en concentration mais souvent c'est pratique donc on le fait quand même...^^)
L'astuce si l'on peut dire revient à multiplier l'égalité par ([Cu2+]i - x/V), tu obtiens alors ton équation du second degré...
C'est très classique comme méthode.
Ah ouais ! En fait je sais pas pourquoi dans ma tête l'équilibre ne correspondait pas à l'état final, mais j'ai compris.
Je vois pas en quoi cette équation K = [Fe2+]i + y / [Cu2+]i - y va nous aider à déterminer les concentrations à l'équivalence...
Du cou j'ai K ([Cu2+]i - y) = [Fe2+]i + y et là je suis perdue
En fait, je t'ai dit une bêtise, tu n'obtiens pas d'équation du 2nd degré mais du 1er.
Comme tu l'as écrit, tu as : K ([Cu2+]i - y) = [Fe2+]i + y
Ensuite, tu isole y exprimé en fonction de K et des deux concentrations connues. y est ton xfinal.
Ensuite tu sais que [Fe2+]final = [Fe2+]i + xfinal et [Cu2+]final = [Cu2+]i - xfinal d'après le tableau d'avancement
Merci ! donc à la fin j'ai bien [Fe2+]f = 1.1 mol/L et [Cu2+]f = 0
La dernière question de l'exercice me pose aussi des problèmes.
Quelle est la masse minimale de la lame de fer pour que ce réactif ne soit pas le réactif limitant ?
Il faut que ni(Fe) 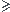 ni(Cu2+)
ni(Cu2+)
Mais il nous manque le volume et j'arrive pas à le remplacer par une expression dont on a les valeurs
oui avec ces seuls données sans le volume, tu ne peux pas trouver de valeur pour m...
Cela dit, tu peux toujours exprimer le nombre de grammes minimal par litre de solution en posant V=1L


