Inscription / Connexion Nouveau Sujet
réaction prépondérante
Bonjour,
dans un bécher contenant 100mL d'eau distillée, on dissout 0.01 mol de méthanoate de méthylammonium. Quelle est la concentration à l'équilibre des ions méthanoate dans la solution?
Données
pKa des couples:
acide méthanoïque/ion méthanoate (HCO2H/HCO2-):3.8
ion méthylammonium/méthylamine (CH3NH3+/CH3NH2):10.6
J'ai tracé un diagramme de pKa (image ci-joint). Sauf qu'apparament je n'arrive pas à trouver la réaction prépondérante. Je sais que la réaction a lieue entre l'acide le plus fort et la base la plus forte ce qui sur le diagramme je crois correspond à l'acide le plus à gauche, et la base la plus à droite. J'avais donc dit que l'acide le plus fort est HCO2H et la base la plus forte CH3NH2. Mais c'est faux donc si quelqu'un pourrait m'expliquer comment faire...
Merci
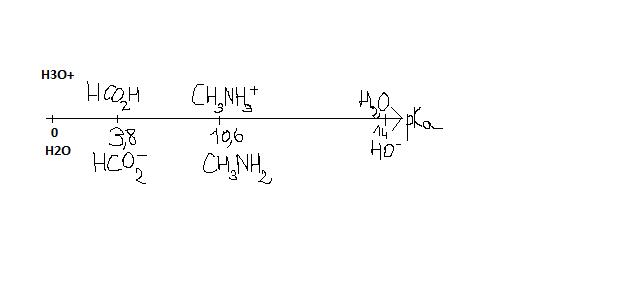
Pas tout à fait.
Tu as mis 10^-2 mol de méthanoate de méthylammonium.
Tu as donc mis: 10^-2 mol de méthanoate (HCO2-) & 10^-2 mol de méthylammonium (CH3-NH3+).
Donc: CH3-NH3+ réagit avec HCO2-. Le gamma est dans le mauvais sens: la réaction est donc limitée.
Donc, l'équation de la réaction c'est:
CH3-NH3+ + HCO2- <--- ---> CH3-NH2 + HCO2H
L'autoprotolyse de l'eau est-elle négligée ? Car sinon, tu as H3O+ qui va d'abord réagir avec HCO2-...


