Inscription / Connexion Nouveau Sujet
Reaction combustion avec reactifs et nombre de mol produit
Bonjour, j'ai un ^roblème avec cette question :
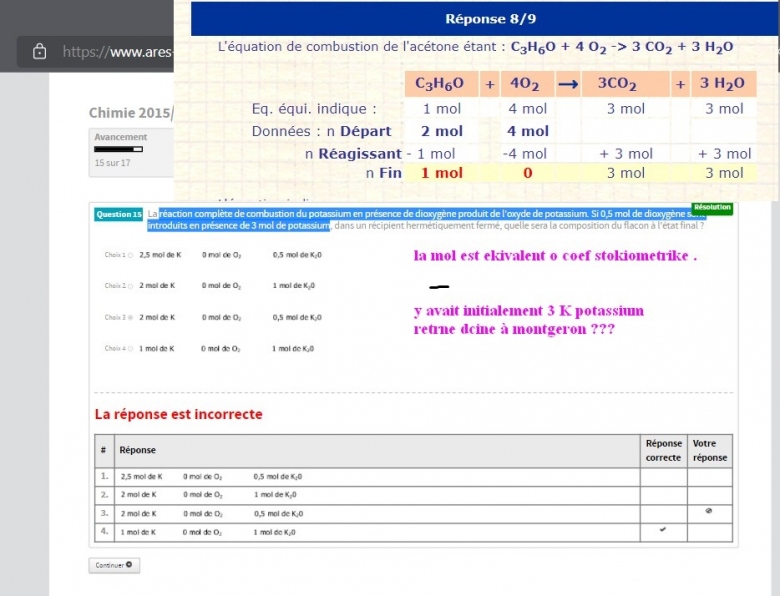
"La réaction complète de combustion du potassium en présence de dioxygène produit de l'oxyde de potassium.
Si 0,5mol de dioxyde sont introduits en présence de 3mol de potassium dans un récipient hermétiquement fermé, quelle sera la composition du flacon à l'état final ?"
Je sais équilibrer des équations de combustions avec reactifs et produits mais je ne sais pas prédire cette reac finale.
J'ai d'ailleurs remarqué que le nombre de mol est équivalement au coeff stochiometrique
Mais je ne sais pas comment arriver à la réponse apr une quelquon que astuce ou déduction ou encore de raisonement relatif à un cours.
La réponse était 1mol de K
0mol de 02
1mol de K2O
Merci
Bonjour,
La première chose à faire est d'écrire l'équation bilan de la réaction de combustion du potassium dans le dioxygène.
salut odbugt1,
Je dirais : K + O2 = KO
3K+ 1/2O2 = ? 3KO1/3
Mais je ne sais pas déjà si j'ai bien respecté la nomenclature et les indices des réactifs . pour les produits afin d'équilibrer je ne sais pas si j'ai le droit de toucher aux indices ou justes aux coeff stochiometriques ?
J'ai donc 3 K et 1 O mais la réponse n'est pas vraiment celle ci...
Si tu ne connais pas la formule chimique de l'oxyde de potassium tu ne peux pas écrire l'équation bilan de la réaction de combustion étudiée ici.
Oxyde de potassium : --->
Merci
-Donc on est censé la connaitre par coeur cette formule K2O ?
ou on peut la déduire du fait que lorsqu'il y a combustion l'indice de l'atome d'oxyde passe à celui de l'autre atome ?
-Puis j'ai cru comprendre qu'avec toute combustion il y avait un reactif fait d'eau et de dioxyde de carbone ? ou bien celà dépend de du réactif limitant ? par exemple propane + dyoxyde ca fait de l'eau et du dyoxide de carbone car dans ,la formule du reactif , le propane il y a du carbone et de l'hydrogène ?
Pour revenir à l'exo
3K + 1/2 02 = K20 + K je pense ?
du coup ici en effet je me débrouile pour avoir mes 3 mols de K et 1 mol de O ?
Donc on est censé la connaitre par cur cette formule K2O ?
Je crois comprendre que cet exercice se présente sous forme de QCM et que dans les propositions de réponses la formule K2O est donnée
Une combustion est une réaction entre un combustible ( ici c'est K ) et un comburant
( ici et très souvent c'est O2 )
Le ( ou les ) produits obtenus sont obligatoirement formés à partir des mêmes éléments chimiques (ici K et O ) que les réactifs.
Pour revenir à l'exo
3K + 1/2 02 = K20 + K je pense ?
Non, car alors l'énoncé aurait dit que la réaction produit de l'oxyde de potassium et du potassium
Or l'énoncé ne parle pas de production de potassium.
De plus K étant un réactif, il ne peut pas être en même temps un produit.
Ici les réactifs sont le potassium ( K ) et le dioxygène (O2) et il ne se forme qu'un seul produit qui est l'oxyde de potassium (K2O)
L'équation bilan est :
a K + b O2 ------- > c K2O
K, O2 et K2O sont des formules chimiques qui ne doivent pas être modifiées.
a, b et c sont des nombres ( entiers de préférence mais pas obligatoirement ) appelés coefficients stchiométriques qui indiquent dans quelles proportions les réactifs sont consommés et le produits sont formés.
Je te laisse trouver les valeurs de a, b , c pour que la règle de conservation des éléments chimiques ( K, O ) soit respectée.
Donc on est censé la connaitre par cur cette formule K2O ?
Je crois comprendre que cet exercice se présente sous forme de QCM et que dans les propositions de réponses la formule K2O est donnée
Ah oui --" l'image que j'ai pris était tellement de mauvaise qualité que j'ai oublié de faire le lien.
Une combustion est une réaction entre un combustible ( ici c'est K ) et un comburant
( ici et très souvent c'est O2 )
Le ( ou les ) produits obtenus sont obligatoirement formés à partir des mêmes éléments chimiques (ici K et O ) que les réactifs.
Merci beaucoup pour l'explication, je vois.
Pour revenir à l'exo
3K + 1/2 02 = K20 + K je pense ?
Non, car alors l'énoncé aurait dit que la réaction produit de l'oxyde de potassium et du potassium
Or l'énoncé ne parle pas de production de potassium.
De plus K étant un réactif, il ne peut pas être en même temps un produit.
Je vois je me disais aussi que ca n'était pas très logique lors de la combustion les reactifs dans cet exo forment donc une molécule et pas une molécule + un atome.
Mais le fait que dans les réponses du QCM il parlait d'un résultat à 1mol de K2O et 1mol de K, ca m'a poussé à rajouter un K --"
Ici les réactifs sont le potassium ( K ) et le dioxygène (O2) et il ne se forme qu'un seul produit qui est l'oxyde de potassium (K2O)
L'équation bilan est :
a K + b O2 ------- > c K2O
K, O2 et K2O sont des formules chimiques qui ne doivent pas être modifiées.
a, b et c sont des nombres ( entiers de préférence mais pas obligatoirement ) appelés coefficients stchiométriques qui indiquent dans quelles proportions les réactifs sont consommés et le produits sont formés.
Je te laisse trouver les valeurs de a, b , c pour que la règle de conservation des éléments chimiques ( K, O ) soit respectée.
D'accord donc on touche uniquement aux coeff stochiométrique des reactifs et profuits pour équlibrer . Sauf que là on nous donne les coefficients des réactifs.
Donc on est censé la connaitre par cur cette formule K2O ?
Je crois comprendre que cet exercice se présente sous forme de QCM et que dans les propositions de réponses la formule K2O est donnée
Une combustion est une réaction entre un combustible ( ici c'est K ) et un comburant
( ici et très souvent c'est O2 )
Le ( ou les ) produits obtenus sont obligatoirement formés à partir des mêmes éléments chimiques (ici K et O ) que les réactifs.
Pour revenir à l'exo
3K + 1/2 02 = K20 + K je pense ?
Non, car alors l'énoncé aurait dit que la réaction produit de l'oxyde de potassium et du potassium
Or l'énoncé ne parle pas de production de potassium.
De plus K étant un réactif, il ne peut pas être en même temps un produit.
Ici les réactifs sont le potassium ( K ) et le dioxygène (O2) et il ne se forme qu'un seul produit qui est l'oxyde de potassium (K2O)
L'équation bilan est :
a K + b O2 ------- > c K2O
K, O2 et K2O sont des formules chimiques qui ne doivent pas être modifiées.
a, b et c sont des nombres ( entiers de préférence mais pas obligatoirement ) appelés coefficients stchiométriques qui indiquent dans quelles proportions les réactifs sont consommés et le produits sont formés.
Je te laisse trouver les valeurs de a, b , c pour que la règle de conservation des éléments chimiques ( K, O ) soit respectée.
Du coup merci pour l'explication très complète

a K + b O2 ------- > c K2O
a et b on nous les a déjà donné 3mol de K et 1/2 mol de O2
a K + b O2 ------- > c K2O
en théorie moi je dirai (si l'on respecte les mol imposées par l'énnoncé en reactif ) 3K +1/2 O2 = 1K2O
le problème c'est qu'à gauche il y a un K en + ? pour l'oxgene c'est bon je crois 1/2O2= O
Ce que je pourrai faire c'est :
4K + 1 O2 ------- > 2 K2O
mais je ne respecte plus le nombre de moles imposés dans l'énnoncé ?
Merci encore et désolé pour le temps pris sur cet exo, hélas je n'ai pas été rigoureux à l'age du lycée inconscient de l'enjeux de l'importance des sciences dans de nombreux domaines.
Ce que je pourrai faire c'est :
4K + 1 O2 ------- > 2 K2O Oui !
mais je ne respecte plus le nombre de moles imposés dans l'énnoncé ?
La réaction est maintenant correctement équilibrée.
Les coefficients stoechiométriques ( 4, 1, 2 ) sont totalement inépendants des données de l'énoncé
L'équation bilan de la réaction est : 4 K + O2 → 2 K2O
Cette équation montre que pour 4 moles de K consommées il est consommé aussi 1 mole de O2 et il est produit 1 mole de K2O
La réaction se poursuit jusqu'à disparition totale de l'un des réactifs appelé " réactif limitant "
L'autre réactif est appelé le " réactif en excès "
Sachant qu'on a mélangé initialement 3 moles de K et 0,5 moles de O2 quel est le réactif limitant ? (Justification obligatoire )
Déduire de ce qui précède la composition du mélange lorsque la réaction est terminée
Ok je comprends l'équation bilan c'est une sorte de vérité de réference de combustion TOTALE(pas de reactif en excès) ? pour ce type de combustion avec laquelle on pourra prédire du coup des réactions.
Juste je te reprends, je pense que tu voulais dire qu'en produit il y a 2 mol de K2O (je me doute que tu voulais dire ca, mais n'ayant pas de bases dans le domaine je préfère etre sur ^^).
si pour consommer 4mol de K on a besoin de 1mol d'O2 .
avec 3 mol de K et 0,5 mol d'O2, à vu d'oeil il nous restera forcément du potassium en excès. Donc le reactif limitant est O2 je pense.
mais dans quel proportions .
pour consommer 2mol de K on aurait donc besoin de 0,5 mol d'O2
donc il restera 1mol de K en excès j'imagine .
ah et du coup tout s'explique : il nous restera 1 mol de K et le produit .
1K + 0,5O2 = K2O
donc on 1 K à gauche en excès et une molécule de K2O lorsqu'on met la quantité de l'énoncé 
Une réaction est totale si elle se poursuit jusqu'à disparition complète de l'un au moins des réactifs.
Une réaction totale peut se produire qu'il y ait ou non un réactif en excès.
Tu as raison, il fallait lire :
Pour 4 moles de K consommées il est consommé aussi 1 mole de O2 et il est produit 2 moles de K2O
Faisons l'hypothèse (volontairement fausse) que ce soit le le potassium (K) le réactif limitant.
Dans ce cas il est consommé la totalité de ce potassium ( 3mol ) et il est consommé aussi ( compte tenu des coefficients stchiométriques ) 4 fois moins soit 0,75 mol de dioxygène.
C'est impossible puisque à l'état initial on ne dispose que de 0,5 mol de dioxygène.
On en déduit que l'hypothèse est fausse et que c'est donc le dioxygène (O2) qui est le réactif limitant.
La totalité du dioxygène ( 0,5 mol) a donc réagi.
Il a réagi en même temps 4 fois plus de potassium soit 4 * 0,5 = 2 mol de ce réactif et
il s'est formé 2 * 0,5 = 1 mol de K2O
La composition du mélange final est donc de :
Pour le potassium : 3 - 2 = 1mol ( Réactif en excès )
Pour le dioxygène : 0 mol ( C'est le réactif limitant )
Pour le K2O :1 mol
Tout cela peut être mis sous forme de tableau comme dans ton post du 05-03-22 à 14:30 ( mais sur une autre réaction).
Une réaction est totale si elle se poursuit jusqu'à disparition complète de l'un au moins des réactifs.
Une réaction totale peut se produire qu'il y ait ou non un réactif en excès.
Tu as raison, il fallait lire :
Pour 4 moles de K consommées il est consommé aussi 1 mole de O2 et il est produit 2 moles de K2O
Faisons l'hypothèse (volontairement fausse) que ce soit le le potassium (K) le réactif limitant.
Dans ce cas il est consommé la totalité de ce potassium ( 3mol ) et il est consommé aussi ( compte tenu des coefficients stchiométriques ) 4 fois moins soit 0,75 mol de dioxygène.
C'est impossible puisque à l'état initial on ne dispose que de 0,5 mol de dioxygène.
On en déduit que l'hypothèse est fausse et que c'est donc le dioxygène (O2) qui est le réactif limitant.
La totalité du dioxygène ( 0,5 mol) a donc réagi.
Il a réagi en même temps 4 fois plus de potassium soit 4 * 0,5 = 2 mol de ce réactif et
il s'est formé 2 * 0,5 = 1 mol de K2O
La composition du mélange final est donc de :
Pour le potassium : 3 - 2 = 1mol ( Réactif en excès )
Pour le dioxygène : 0 mol ( C'est le réactif limitant )
Pour le K2O :1 mol
Tout cela peut être mis sous forme de tableau comme dans ton post du 05-03-22 à 14:30 ( mais sur une autre réaction).
Je vois , merci pour le rectificatif sur l'indépendance entre une reaction totale et reactif en excès !
Pour le reste c'est encore bien expliqué de ta part

Oui je vois au niveau du tableau.