Inscription / Connexion Nouveau Sujet
Question sur la mole
***Bonjour***
En fait et comme vous savez en a fait le mol mais ...... j'ai pas bien compris par ce que le prof ..... et moi je faisais pas des cours hors le lycée donc je vous demande si vous pouviez m'aider a comprendre les principes de cette lecon très importante
Merci d'avance
***Titre changé pour plus de clarté***
Salut,
Il y a des fiches de cours sur le sujet (cf. sur le site, onglet fiches).
Les as-tu regardé ?

Bonjour,
Tout d'abord, la matière est composée d'entités chimiques ; celles-ci sont présentes en quantité gigantesque.
Afin de faciliter le comptage, elles sont regroupées par "paquets" appelés moles.
Chaque mole contient un nombre précis d'entités chimiques : 6,02 x 1023 .
Ce nombre est appelé constante d'Avogadro. On le note NA = 6,02 x 1023 mol-1
Le nombre de moles, autrement dit le nombre de paquets, est appelé quantité de matière et noté n.
Une relation existe entre ces notions : N = n x NA où N est le nombre d'entités chimiques, n est la quantité de matière et NA est la constante d'Avogadro.
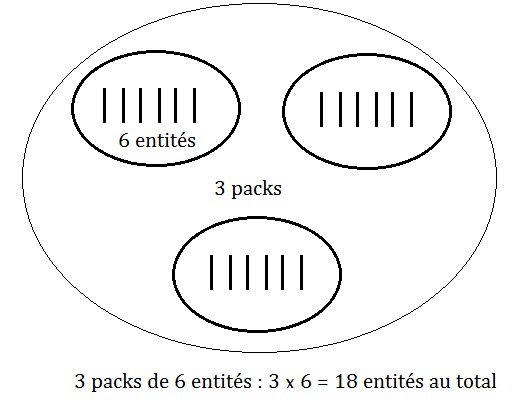
Comme exemple concret, prenons celui des packs d'eau.
Le nombre d'entités chimiques N représente le nombre total de bouteilles ; la quantité de matière n correspond au nombre de packs d'eau ; la constante d'Avogadro correspond au nombre de bouteilles dans un pack.
S'il y a 3 packs de 6 bouteilles : N = 3 x 6 = 18 bouteilles.
Voir schéma ci-dessous.
La masse molaire atomique est la masse d'une mole composée seulement d'atomes. Elle s'exprime en g/mol. Par définition, une mole d'atomes d'hydrogène pèse 1 g, soit M(H) = 1 g/mol.
La masse molaire moléculaire est la masse d'une mole de molécules. Une molécule est un assemblage d'atomes, comme par exemple l'eau H2O qui contient 2 atomes d'hydrogène H et 1 atome d'oxygène O.
Pour calculer la masse molaire moléculaire, on fait la somme des masses molaires de chaque atome.
Ainsi M(H2O) = 2 M(H) + M(O),
M(H2O) = 2 x 1 + 16
M(H2O)= 18 g/mol
En espérant que toutes ces informations pourront t'aider,
MX