Inscription / Connexion Nouveau Sujet
qcm
Bonsoir à tout le monde j'ai un qcm à faire pour demain, j'ai commencé ce qcm mais je voulais une vérification et si possible m'aider pour la fin des autres questions
je vous remercie d'avance cordialement Louise
voici le qcm:
1) Une solution aqueuse de chlorure de fer II, de formule FeCl2 .
soit a)contient deux fois plus d'ions fer II que d'ions chlorure.
soit b)contient autant d'ions fer II que d'ion chlorure.
soit c)contient deux fois plus d'ions chlorure que d'ions fer II.
(J'ai répondu la c))
2) L'équation de dissolution du sulfate fer III, de formule Fe2(SO4)3 .
soit 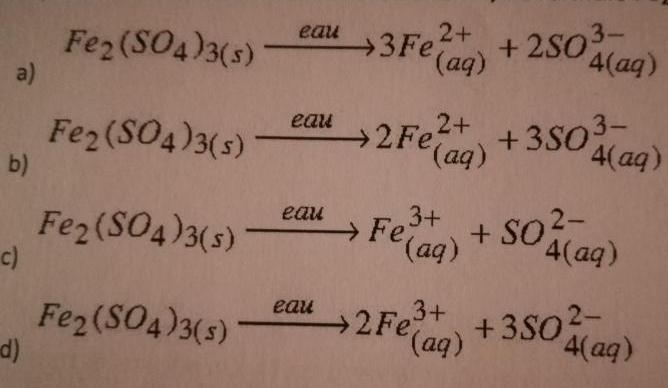
(j'ai répondu d))
3) Pour la solution de sulfate de fer III, la relation entre les concentrations molaires des ions dans la solution et la concentration C de la solution est:
soit a) [Fe3+] = [SO42-] = C
soit b) [Fe3+] = 3 C et [SO42-] = 2C
soit c) [Fe3+] = 2C et [SO42-] = 3C
4) Pour obtenir 200mL d'une solution de sulfate de fer III de concentration C= 0.050mol.L-1 la masse de Fe2(SO4)3 à dissoudre est:
a) 100g
b)25g
c)40g
(j'ai répondu c))
5) Le changement d'état de la glace à l'eau liquide se caractérise par:
a) une température constante, un volume constant et une masse constante.
b) une température constante, une masse constante et un volume différent.
c) une température constante, un volume constant et une masse différente.
d) une température constante, un volume différent et une masse différente.
(j'ai répondu b))
6) On chauffe un corps à l'état solide en relevant la température toutes les minutes.
A 6,5°C la température reste constante 4 minutes puis recommence à monter. On peut dire:
a) La température de 6,5°C est sa température de fusion.
b)Le corps est liquide depuis 0°C.
c) Le solide s'est liquéfié puis est redevenu solide et c'est pourquoi la température remonte.
(j'ai répondu a) et b))
7) Quand on met un glçon dans un verre d'eau à température ambiante
a) le glaçon prend de l'énergie à l'eau.
b) le glaçon commence par se réchauffer puis fond
c) le glaçon commence par fondre puis se réchauffe
d) l'eau du verre se solidifie
e) l'eau du verre et le glaçon voient leur température augmenter
f) l'eau du verre et le glaçon atteignent la même température
(j'ai répondu a), b), et f))
8)On sort un glaçon de masse mg=20 grammes du congélateur réglé à Tc = -18°C et on le met dans un verre contenant V=1,5 dl d'eau à Ti = 18°C. Après quelques minutes la température de l'eau dans le verre est Tf. On néglige les transferts d'énergie avec l'air environnant.
Données: A 0°C, la chaleur latente de fusion de la glace est de L=333J.g-1 et sa capacité thermique massique de l'eau à 0°C(Ce =4,217J.g-1.°C-1)
Les différentes énergies mises en jeu dans cette expérience sont:
a) E1= -mg.Cg.Tc
b) E2= mg.L
c)E3= mg.Ce.Tf
d)E4= me.Ce.(Tf-Ti)
Les différents échangent thermiques entre l'eau du verre et le glaçon sont:
e) l'eau du verre se refroidit
f) le glaçon se réchauffe
g) le glaçon fond
h) l'eau du glaçon se réchauffe
8.1 Associer chaque énergie à l'étape correspondante
(j'ai répondu b) -> g)
c) -> h)
d) -> e)
a) -> f))
8.2 Afin de calculer la température finale de l'eau dans le verre on peut poser:
A) E1= E2+E3+E4
B) E1 + E2= E3 + E4
C) E1+E2+E3=E4
(je n'ai pas répondu à celle ci)
8.3 Déterminer la valeur de Tf à l'aide des données numériques
(je n'ai donc pas pu répondre)
Cordialement Louise
Bonjour,
Attention la prochaine fois avec les QCM, il mélange à la fois des questions de chimie et de physique, sur plusieurs thème, la règle 1 sujet = 1 exercice n'est pas vraiment respectée.
___________________________________________________
1) Une solution aqueuse de chlorure de fer II, de formule FeCl2 .
soit a)contient deux fois plus d'ions fer II que d'ions chlorure.
soit b)contient autant d'ions fer II que d'ion chlorure.
soit c)contient deux fois plus d'ions chlorure que d'ions fer II.
2)
3) Formule chimique de la solution aqueuse :
Pour 1 mole de sulfate de fer (III) dissoute, il se forme 2 moles d'ions fer (III) et 3 moles d'ions sulfate
Conclusion ?
4) Pour obtenir 200mL d'une solution de sulfate de fer III de concentration C= 0,050 mol.L-1 la masse de Fe2(SO4)3 à dissoudre est :
or
soit
et donc
Conclusion ?
5) Le changement d'état de la glace à l'eau liquide se caractérise par:
a) une température constante, un volume constant et une masse constante.
b) une température constante, une masse constante et un volume différent. => TB !
c) une température constante, un volume constant et une masse différente.
d) une température constante, un volume différent et une masse différente.
6) On chauffe un corps à l'état solide en relevant la température toutes les minutes.
A 6,5°C la température reste constante 4 minutes puis recommence à monter. On peut dire:
a) La température de 6,5°C est sa température de fusion.
b)Le corps est liquide depuis 0°C.
c) Le solide s'est liquéfié puis est redevenu solide et c'est pourquoi la température remonte.
(j'ai répondu a) et b)) --> revois la notion de palier de fusion
7) Quand on met un glaçon dans un verre d'eau à température ambiante
a) le glaçon prend de l'énergie à l'eau.
b) le glaçon commence par se réchauffer puis fond
c) le glaçon commence par fondre puis se réchauffe
d) l'eau du verre se solidifie
e) l'eau du verre et le glaçon voient leur température augmenter
f) l'eau du verre et le glaçon atteignent la même température
(j'ai répondu a), b), et f)) --> TB !

8)On sort un glaçon de masse mg=20 grammes du congélateur réglé à Tc = -18°C et on le met dans un verre contenant V=1,5 dL d'eau à Ti = 18°C. Après quelques minutes la température de l'eau dans le verre est Tf. On néglige les transferts d'énergie avec l'air environnant.
Données:
A 0°C, la chaleur latente de fusion de la glace est de L=333J.g-1
et sa capacité thermique massique de l'eau à 0°C (Ce =4,217J.g-1.°C-1)
Les différentes énergies mises en jeu dans cette expérience sont:
a) E1= -mg.Cg.Tc
=> cela correspond à l'énergie reçue par les glaçons pour le réchauffer de -18°C à 0°C
b) E2= mg.L
=> palier de fusion de l'eau à 0°C, passage de l'état solide à l'état liquide, qui se fait par le biais de la chaleur latente de fusion
c)E3= mg.Ce.Tf
=> réchauffage de l'eau fondu de 0°C à Tf
d)E4= me.Ce.(Tf-Ti)
=> refroidissement de l'eau du verre de 18°C à Tf (= énergie perdue par l'eau du verre)
Les différents échangent thermiques entre l'eau du verre et le glaçon sont:
e) l'eau du verre se refroidit => E4 (d)
f) le glaçon se réchauffe => E1 (a)
g) le glaçon fond => E2 (b)
h) l'eau du glaçon se réchauffe => E3 (c)
8.1 Associer chaque énergie à l'étape correspondante
(j'ai répondu b) -> g) TB
c) -> h) TB
d) -> e) TB
a) -> f)) TB
8.2 Afin de calculer la température finale de l'eau dans le verre on peut poser:
A) E1= E2+E3+E4
B) E1 + E2= E3 + E4
C) E1+E2+E3=E4
C'est un bilan d'énergie qu'il faut écrire:
- d'un côté, la glace absorbe de l'énergie pour atteindre la température finale du mélange : E1 puis E2 puis E3
- de l'autre, l'eau du verre perd son énergie pour atteindre la température finale : E4
donc E1 + E2 + E3 = E4.
8.3 Déterminer la valeur de Tf à l'aide des données numériques
=> attentions aux unités des données fournies par l'énoncé.

gbm
j'ai réussi à comprendre et à répondre et je vous remercie vraiment de m'avoir aidé.
Mais j'ai juste une question par rapport à la 8.2, j'ai trouvé pour E1=741,6; pour E2=6660; pour E3= 20*4,217 (et après je ne sais pas sachant que l'on cherche Tf) et E4=(150*4,217)*(Tf-18)= 632,55*(Tf-18) Mais là encore le même soucis...
Attention, un résultat en physique sans unité c'est 0 le jour du bac  .
.
Vérifie si tu n'as pas fait d'erreur de conversion d'unité dans les applications numériques.
Ensuite, exprimer E1 + E2 + E3 = E4 revient à résoudre une équation du premier degré à 1 inconnue : Tf.
Cela revient à faire appel à des notions de maths.

Ici l'énergie est exprimée en joules (J) et la température est en degrés Celsius (°C)
Ta température est du bon ordre de grandeur.



