Inscription / Connexion Nouveau Sujet
Protection du fer par étamage
J'aimerais de l'aide pour commencer mon exercice je n'arrive pas à démarrer...
Certaines boite de conserve sont en fer blanc, matériau constitué d'une feuille d'acier(0,2mm) recouverte d'une couche d'étain (1 m).
Cette couche d'étain est déposé par électrolyse. Des réactions électrochimiques se produisent aux électrodes.
L'électrolyte est une solution acidifiée de sulfate d'étain (II), Sn2+(aq) + SO2-4 (aq) à 50 g/L.
Divers additifs permettent une bonne adhésion de l'étain sur l'acier lors du chauffage final de la plaque après électrolyse.
La cathode est constitué de la boite de fer à étamer de surface totale S=300cm2. L'anode est en étain.L'intensité du courant d'électrolyse vaut I=2,40 A. Le dépôt réalisé a une épaisseur de 1,00m.
On admettra que seul l'élément étain réagit aux électrodes.
Données: Masse vol. de l'étain: (Sn)=7,30 g.cm-3
La charge électrique Q qui traverse le circuit vaut Q=I x t = n(e-) x F avec F = 9,65 x 104C.mol-1
PROBLEME:
Après avoir justifier la nature des électrodes et de l'électrolyte, faire un schéma de l'expérience, puis déterminer la durée minimal, tmin de l'électrolyse.
En réalité, la durée t nécessaire au dépôt voulu est supérieur à tmin. Proposer une explication
Merci d'avance ..
Bonjour,
Alors, j'ai fais un schéma explicatif.
Pour la suite, je ne suis pas sûre mais voilà comment je procède :
Le bain électrolyte contient du sulfate d'étain, Sn2+ est réduit à la cathode selon l'équation suivante :
Sn2+ + 2 e- = Sn(s)
La quantité de matière qui doit être formée lors de l'électrolyse est :
n(Sn) = m(Sn)/M(Sn)
 (
(  (Sn)
(Sn)  V(Sn) )/(M(Sn))
V(Sn) )/(M(Sn))
 (
(  (Sn)
(Sn)  e
e  S )/(M(Sn))
S )/(M(Sn))
où e est l'épaisseur, S la surface.
Par ailleurs : Q = 2 n(Sn)  F
F
Comme la quantité d'électricité délivrée par le générateur est Q = I*t, on obtient donc :
t = Q/I  (
( (Sn)
(Sn)  )/I
)/I
Soit : (2
 (Sn)
(Sn)  e
e  S
S  F)/ (I
F)/ (I M(Sn) )
M(Sn) )
On fait l'application numérique est on a donc t en secondes puis on le convertit en minutes.
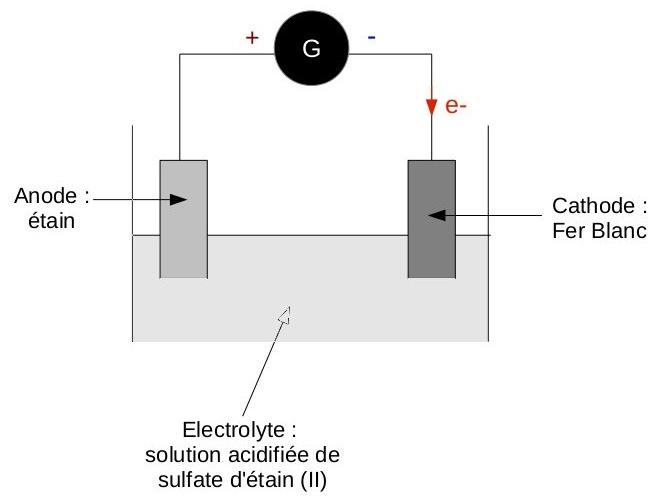
**Le bain électrolyte contient du sulfate d'étain, Sn2+ est réduit à la cathode selon l'équation suivante :
Sn2+ + 2 e- = Sn(s)
**Comme la quantité d'électricité délivrée par le générateur est Q = I*t, on obtient donc :
t = Q/I  (
( (Sn)
(Sn) V(Sn) )/I
V(Sn) )/I
Désolée, j'ai écris un peu vite mais voilà, j'ai rectifié


