Inscription / Connexion Nouveau Sujet
Question 4)
on cherche la concentration de S'0. On connait l'absorbance de cette solution (elle se nomme A' qui est égale à 1.45)
en utilisant le graphique, tu en déduis par lecture la concentration de la solution
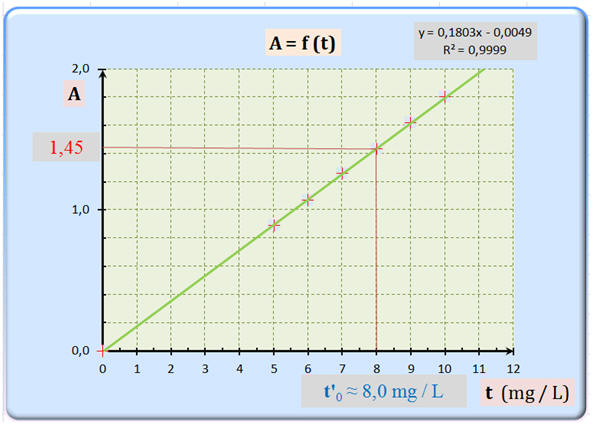
Initialement, on verse 5 ml de S0 dans une fiole de 50mL pour obtenir S'0 = 8mg/L
donc S'0 est dix fois moins concentrée que S0 donc S0 = 8*10 = 80mg/L
la concentration de S0 est 80mg/L contenue dans une fiole de 1000mL soit 1 L donc la masse d'ions Fe2+ est de 80mg
il y a un calcul implicite:
la concentration de S0 est 80mg/L contenue dans une fiole de 1000mL soit 1 L donc la masse d'ions Fe2+ est de 80*1 = 80mg
oui c'est vrai.
En fait, tu as une concentration de 80 mg/L dans une fiole d'un litre donc la masse est de 80mg
la suite?
oui
je comprend jusque la :
M (Fe) = 56 g / mol ; M (S) = 32 g / mol ; M (O) = 16 g / mol ; M (H2O) = 18 g / mol
M (FeSO4, n H2O) = M (Fe) + M (SO4) + n M (H2O)
M (FeSO4, n H2O) = 56 + 96 + 18 n = 152 + 18 n
et après je sais pas quoi faire
il faut se servir de l'énoncé:
D'après la notice, la masse de "sulfate ferreux déshydratée" dans un comprimé est de 256,30 mg alors que la masse d'ions Fe2+ est de 80 mg.
Pour un comprimée, il y a donc 80 mg d'ions fer II dans 256.30mg de sulfate ferreux déshydratée
Pour une mole, il y a 56 g de FerII dans 152 + 18 n g de sulfate ferreux déshydratée
donc
80 mg  256.30
256.30
56  152+18n
152+18n
80*(152+18n) = 256.30*56
152+18n = (256.30*56)/80
18n = (256.30*56)/80 - 152
n = ((256.30*56)/80 - 152)/18
n = 1.5 (a vérifier)




