Inscription / Connexion Nouveau Sujet
problème de chimie sur l'electrolyse
J'ai un petit exo de chimie à faire, mais je bloque sur la premiere question or les suivantes en découlent. Je vous donne le sujet au cas où vous puissiez m'aidez. Merci d'avance.
On considère l'argenture industrielle d'un seau à champagne en acier de surface S= 800cm2: on souhaite réaliser un dépot d'argent de 8 m. Le courant d'électrolyse est de 45A et la tension aux bornes des électrodes est de 0.80V; l'electrolyse utilisé a été obtenu en dissolvant, par litre de solution, 60,0g de cyanure d'argent et de potassium AgK(CN)2et 90g de cyanure de potassium KCN.
m. Le courant d'électrolyse est de 45A et la tension aux bornes des électrodes est de 0.80V; l'electrolyse utilisé a été obtenu en dissolvant, par litre de solution, 60,0g de cyanure d'argent et de potassium AgK(CN)2et 90g de cyanure de potassium KCN.
La cathode est constitué d'un seau à argenter et l'anode est de l'argent pur; la masse volumique de l'argent est  = 10.5g.cm-3. Les ions cyanure et potassium sont ici des ions spectateurs. On admettra que cette eletrolyse est un exemple d'electrolyse "à anode soluble".
= 10.5g.cm-3. Les ions cyanure et potassium sont ici des ions spectateurs. On admettra que cette eletrolyse est un exemple d'electrolyse "à anode soluble".
En presence d'ions cyanure CN- en excès, les ions argent (I) AG+ donnent un ion complexe de formule [Ag(CN)2]-.
La constante d'équilibre correspondant à la formation de cet ion vaut K=1020.
1) Déterminer les concentrations apportées en ions cyanure et en ions argent.
2) En déduire que l'élément argent en solution l'est principalement sous forme d'ions complexes [Ag(CN)2]-.
3) Ecrire les équations des réactions se produisant aux élctrodes en considérant, dans un premier temps, que c'est l'ion AG+ qui intervient. Corriger, ensuite , l'écriture de ces équations en tenant compte du fait que c'est l'ion [Ag(CN)2]- qui est mis en jeu.
4)Sachant que le rendement de cette electrolyse est de 95%, calculer la durée minimale nécessaire pour obtenir le dépot souhaité et l'énergie électrique alors consommée.
L'énoncé est un peu long. Désolé. C'est surtout la première question qui me pose un problème. Si queiqu'un poouvait me mettre sur la piste svp.
Merci d'avance 
j'ai le même problème que toi à faire et j'ai réussi une partie du problème mais mes résultats semblent un peu bizarres donc si quelqu'un l'a déjà fait j'aimerais pouvoir comparer mes résultats.
salut:
1) pour déterminer les concentrations apportées en ions cyanure et en ions argent.
les 60,0g de cyanure d'argent apportent à la solution:
AgCN -----------> Ag+ + CN-
(s) (aq) (aq)
=>.
et [CN-]=0,45mol/L
mais l'addition de 90g de cyanure de potassium KCN ne modifira pas la concentration de Ag+ mais elle entrainera :
KCN ----> k+ + CN-
=1,38mol/L.
donc : =>.
[tex][CN-]=0,45+1,4=1,83mol/L.
2)Ag+ + 2 CN- = [Ag(CN)2]-.
(aq) (aq) (aq)
Qr,i=0 => l'équilibre évoluera ds le sens direct ,d'ou formation de l'ions complexe.
3) équations des réactions se produisant aux élctrodes .
il s'agit d'electrolyse "à anode soluble".
oxydation anodique: réduction cathodique: Ag+ +e- --> Ag
or du que fait que c'est l'ion [Ag(CN)2]- qui est mis en jeu.
l'élément argent en solution l'est principalement sous forme d'ions complexes [Ag(CN)2]-.
donc la 2ème demi équation Ag+ + e- --->Ag s'écris:
Ag(CN)2- +e- ----> Ag +2 CN-
bonjour,
merci beaucoup pour cette analyse je me rend compte que j'étais sur la bonne voie.Ca me rassure.
pour la quatrième question il faut utiliser le rendement
j'ai donc effectuer les calcus suivants:
masse réelle/masse théorique= 95°/°
d'où masse réelle= 10.5*800*8.1o-4*95/100
=6.384 g
puis j'ai calculé n(Ag)= m(Ag)/M(Ag)=6.384/107.9=0.059 mol
puis j'ai utilisé Q= ne- F
or ne-=n(Ag)
Q=0.059*96500=5694C
puis pour trouver la durée j'ai calculé
Q= it
t=Q/i soit t=5694/45=127s ou 2 min 7s
J'aimerais savoir si ma démarche est bonne
merci d'avance.
la masse réelle qu'on doit déposer sur la plaque est :
m= .V=
.V= Ag.S.e
Ag.S.e
S=800cm2 e= 8 m=8.10-4 cm
m=8.10-4 cm  = 10.5g.cm-3.
= 10.5g.cm-3.
or le rendement n'est que 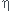 =95% ,la masse théorique m' doit etre plus grande pour arriver à déposer la masse expérimentale:
=95% ,la masse théorique m' doit etre plus grande pour arriver à déposer la masse expérimentale:
or : Ag+ + e- --> Ag
n(e-)=n(Ag)
càd:
donc:
merci beaucoup de ton aide
j'avais pris le problème de rendement à l'envers
toutefois en reprenant ton résultat pour m(Ag)=7.07g je ne trouve pas t=1444s mais 141 s
en effet,
t= (m' . Q)/ (i . M(Ag))
t= (7.07 . 96500)/(45 . 107.9)
je ne sais donc pas quel est mon erreur de calcul.
bonjour,
je suis actuellement en train de reprendre le problème et je me rend compte que je ne suis pas tout à fait d'accord avec la réponse à la première question:
1) pour déterminer les concentrations apportées en ions cyanure et en ions argent.
les 60,0g de cyanure d'argent apportent à la solution:
AgCN -----------> Ag+ + CN-
(s) (aq) (aq)
[Ag+]=0.45mol/L
en effet d'après l'énoncé on a 60.0g de cyanure d'argent ET de potassium
AgK(CN)2
donc M=199 g/mol et non pas M=133.9 g/mol
ainsi on a [Ag+]=0.3 mol/L
Ai-je tort?
merci d'avance


