Inscription / Connexion Nouveau Sujet
pression de l'air dans un ballon
Bonsoir
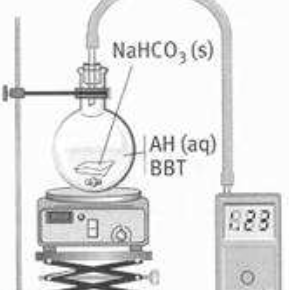
dans cet exercice , on regarde l'action de l'acide éthanoique sur l'hydrogénocarbonate de sodium
il faut introduire
1) un volume V = 1,0 ml d'une solution aqueuse d'acide de concentration C = 0,50 mol.L-1
que l'on complète à 20 ml avec de l'eau distillée
2)on introduit ensuite dans le ballon un morceau de papier filtre contenant 0,21 g d'hydrogénocarbonate de sodium
3) on mesure la pression au début de la réaction
4)on mesure la pression à la fin de la réaction
j'ai calculé les quantités de matières initialement présentes
quantité de matière CH3 COOH
quantité de matière Na H CO3
voici ce que je ne comprends pas
à l'état initial
je vais avoir les deux quantités de matières que je viens de calculer
et une quantité d'air
donc
lorsque je vais faire ma première mesure de pression , je vais avoir la pression de quel gaz ??
pouvez vous m'expliquez , s'il vous plait
mais pour calculer la quantité de matière initialement présente de CH3 COOH , attention la solution a été dilluée .
tu dois appliquer la relation de dillution pour trouver la nouvelle concentration de l'acide.
Bonjour
b. En utilisant l'équation d'état des gaz parfaits, montrez que la quantité de matière de gaz formé nf(CO2) s'exprime par la relation : n f (CO2 ) = ∆P × V total / R * T
pour cette question il faut trouver la quantité de CO2 qui est dégagé par la réaction
donc au cours de la transformation
les quantités de matière de CH3 COOH et de NaH CO3 vont diminuer
et la quantité de matière de CO2 va augmenter
puis à la fin de la réaction
il y aura un des 2 réactifs qui aura disparu
c'est bien cela ??
Bonjour 124 geegee
merci de m'avoir répondu
dans la question 2 ° )
il faut montre que la quantité de matière de gaz formé nf(CO2) s'exprime par la relation : n f (CO2 ) = ∆P × V total / R * T
delta P étant l'écart de pression entre la pression initiale Pi et la dernière pression qui est faite en fin de réaction
est ce bien cela ??
en fait j'ai un peu de mal à comprendre cette expérience
peut tu m'aider un peu ?
s'il te plait
Bonjour
Ici la pression que je mesure après réaction est-elle seulement celle de CO2 ?
au cours de la transformation
les quantités de matière des 2 réactifs vont diminuer (pendant toute la durée de la réaction)
à la fin de la transformation
il y aura au moins un des 2 réactifs qui aura disparu
soit l'hydrogénocarbonate de sodium
soit le vinaigre
et le réactif qui aura disparu sera le réactif limitant
donc la pression relevée à la fin de la réaction sera t elle seulement celle du CO2 ???
je dirais que il ya le CO 2 qui s'est formée mais aussi la quantité d'ait initialment présente est ce que c'est bon ??
Salut:
Au début de l'expérience il n'ya que de l'air dans le ballon . la pression dedans est la pression atmsphérique .Patm
La relation des gaz parfait : P(CO2).V=n(CO2) R.T (1)
L e baromètre mesure la pression totale ; P=Patm+P(CO2)
donc : P(CO2)=P-Patm
c'est à dire : P(CO2)= P
P
donc la relation (1) devient :  P.V=n(CO2) R.T
P.V=n(CO2) R.T
d'ou: n (CO2 ) =( ∆P. V ) / R . T
La quantité de matière initialement présente de CH3 COOH
Or le volume V = 1,0 ml de la solution aqueuse d'acide de concentration C = 0,50 mol.L-1
a été diluée par 20 ml d 'eau distillée .
Soit C' la concentration de la sol diuée.
la relation de dilution : C.V =C'V'
 C'=C.V/V'=0,5
C'=C.V/V'=0,5 1/20=0,025mol.
1/20=0,025mol.
donc on a un mélange stochiométrique.
Bonjour Sbiro
tout d'abord je te remercie de m'avoir répondu
je viens seulement de lire ton message
à l'état initial
n(CH3 COOH) = 0,025 mol
à l'état final
reste t-il de l'acide ?
reste t-il du l'hydrogénocarbonate de sodium ??
n (CO2) = ????
il y a un des 2 réactifs qui aura disparu et il constituera le réactif limitant
s'il n'y a plus d'acide , ce sera le réactif limitant ?
c'est bien cela ??
Bonjour ,
j'ai essayé de faire un tableau d'avancement
| équation chimique |
| état du système | avancement | ||||||
| état initial | x = 0 | 0,0025 | 0,025 | 0 | 0 | 0 | 0 |
| au cours de la transformation | x | 0,0025 - x | 0,025-x | ||||
| état final | x max =0,0025 | 0,025 - 0,0025 = 0,0225mol |


