Inscription / Connexion Nouveau Sujet
Polarité d'une molécule
Bonsoir à tous.
J'ai un DM à rendre et je n'ai pas bien compris quelques questions :
On me demande pourquoi le diiode est peu soluble dans l'eau et le triiodure est soluble dans l'eau.
Je sais que plus un ion est petit et que sa charge est grande, plus il sera soluble mais je ne vois pas pourquoi le diiode est peu soluble alors que le triiodure l'est.
De plus on me demande la formule de Lewis du diiode mais je ne trouve pas comment la trouver dans mon livre de Chimie. On me fait remarquer que l'iode possède 7 électrons sur sa couche externe.
Merci de bien vouloir me répondre.
Bonne soirée. Claire
Salut !
!
Lors de la mise en solution aqueuse du solide ionique, l'eau détruit le cristal.
L'électronégativité d'un élément est la tendance d'un atome de cet élément à attirer le doublet d'une liaison covalente dans laquelle il est engagé.
D'une façon générale,
- l'électronégativité des éléments augmente lorsqu'on se déplace de gauche à droite dans une période (ligne) du tableau périodique des éléments;
- l'électronégativité des éléments augmente lorsqu'on se déplace de bas en haut dans une famille (colonne) du tableau périodique des éléments.
Prenons HCl pr exemple:
Le chlore est plus électronégatif que l'hydrogène. Le doublet qui assure la liaison entre ces deux atomes se déplace vers le chlore.
Il apparaît donc, au voisinage de l'hydrogène, une densité électrique positive (notée  +) qui correspond à un déficit électronique sur cet atome.
+) qui correspond à un déficit électronique sur cet atome.
Il apparaît de même, au voisinage du chlore, une densité électrique négative (notée  -) qui correspond à un excès électronique sur cet atome.
-) qui correspond à un excès électronique sur cet atome.
Il apparaît donc deux pôles électriques différents et distincts aux extrémités de la liaison H—Cl. On dit que cette liaison est polarisée. Il en résulte que la molécule HCl présente un caractère polaire.

L'eau: L'électronégativité de l'oxygène est plus forte que celle de l'hydrogène. Une étude du déplacement des doublets de liaison semblable à celle conduite dans le paragraphe précédent montre que les liaisons O—H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2 -) et que chaque hydrogène porte une densité électrique positive (
-) et que chaque hydrogène porte une densité électrique positive ( +).
+).
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène. Il apparaît alors qu'étant donnée la forme de la molécule d'eau, les barycentres des densités électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire (on dit dipolaire si il y a deux pôles).
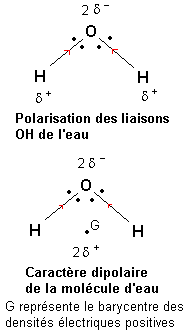
Ce caractère dipolaire de la molécule d'eau lui confère des propriétés de solvant très particulier.
Csqce du caractère dipolaire de l'eau: L'eau a pour propriété de détruire les solides ioniques et de disperser les ions. Ces phénomènes s'accompagnent du phénomène de solvatation des ions. Cette solvatation est due au caractère dipolaire de l'eau.
Les cations en solution attirent (interaction électrique) les molécules d'eau par leur partie négative. Il en résulte que chaque cation s'entoure d'un certain nombre de molécules d'eau.
Les anions en solution attirent les molécules d'eau par leur partie positive. Il en résulte que chaque anion s'entoure d'un certain nombre de molécules d'eau.
Ce phénomène est appelé solvatation des ions. Lorsque le solvant est l'eau elle est appelée hydratation.
Maintenant tu appliques le principe d'HCl à tes molécules...
Lewis pour le diiode: Tu as dc en tt 6 doublets non-liants et 1 liaison...
- -
|I - I|
- -
Ca d'accord, mais quel rapport avec la question ?
En quoi cela explique-t-il que le diiode est moins soluble que l'ion triiodure ?
Le diiode est peu soluble dans l'eau car c'est une molécule apolaire et que l'eau est un solvant polaire.
En revanche l'anion triiodure est soluble dans l'eau pusque c'est un ion...


