Inscription / Connexion Nouveau Sujet
Polarisation des liaisons
Bonjour je suis en train d'étudier ce chapitre et j'ai du mal à comprendre (enfin je ne sais pas si ce que je pense est juste ou s'il y a d'autres subtilités à comprendre) .
J'aimerai beaucoup que vous me donniez une réaction chimique (addiction, substitution ou élimination qu'importe) et que je vous dise de quel type de réaction il s'agit et que je parvienne à identifier les liaisons rompues et les liaisons créées.
Salut 
Bon je sais pas exactement ce que tu dois être capable de faire, mais je vais quand même essayer^^
Tu préfères que je te donne des réactions en formules semi-développées comme sur l'image, ou que je te décrive la réaction à l'écrit ?
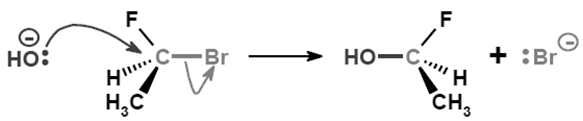
Genre : le 1-bromo-1-fluoroéthane et la potasse réagissent pour former ...

C'est parfait 
Alors comme on a intervertit Br et OH alors c'est une réaction de substitution.
Les produits formés sont :
1-fluoro-1-éthanol et du bromure de potassium.
Les liaisons créées sont : C---OH et K---Br tandis que les liaisons brisées sont :
C---Br et K---OH .
Soit X(y) l'électronégativité de tout atome y.
X(O)=3,44 et X(K)=0,82 donc l'atome d'oxygène est plus électronégatif que l'atome de
potassium. Donc K porte une charge partielle positive tandis que O porte une charge partielle négative. La liaison est donc polarisée.
O est le site donneur et K est le site accepteur d'électrons ?
Effectivement c'est une réaction de substitution 
Alors pour commencer, je suis pas très doué en nomenclature mais j'aurais plutôt dit 1-fluoroéthan-1-ol ou même 1-fluoroéthanol^^
Enfin bref c'est pas important ça 
Pour le reste y'a pas mal d'erreurs...
Mais c'est pas grave, c'est tout l'intérêt de s'entraîner 
Tout d'abord, on ne forme pas de "bromure de potassium" !
Je m'explique : quand on marque "K+, HO-" ou "K+, Br-", c'est juste pour préciser quel ion assure l'électroneutralité de la solution.
En réalité, tous ces ions sont dissous et ne sont absolument pas liés entre eux par liaison covalente .
En conclusion, il y'a donc :
- une seule liaison rompue : C --- Br
- une seule liaison formée : C --- OH
Du coup, tout ce que tu dis sur la polarisation de la liaison K --- O est faux puisque la liaison n'existe pas  (mais ton raisonnement sur la différence d'électronégativité était bon par contre^^)
(mais ton raisonnement sur la différence d'électronégativité était bon par contre^^)
Voilà comment les choses se passent en réalité :
- les ions hydroxyde HO- sont d'excellents nucléophiles (ce sont des anions avec des doublets non liants !)
- le carbone de la première molécule est un site électrophile : en effet, il est lié à un atome plus électronégatif (Br) et possède donc une charge partielle positive  +
+
Ainsi : un doublet non liant de l'ion HO- va former une liaison avec le carbone (on parle d'"attaque nucléophile"), provoquant ainsi la rupture de la liaison C --- Br et la libération d'un ion Br-
Je t'ai mis un schéma de la réaction, pour que tu vois bien les déplacements d'électrons^^
Si tu as tout compris je te donnerais d'autres réactions 
D'accord , par contre je pensais que le ":" symbolisait une double liaison mais en réalité les deux atomes ne sont pas liés entre eux
Oui j'aimerai beaucoup que vous me donniez une réaction (assez compliquée) et en formule topologique (ou de Lewis)