Inscription / Connexion Nouveau Sujet
pile+oxydoréduction
slt à tous , je bloque dans cette question merci pour votre aide
on verse une solution d'acide chlorydrique dans deux tubes à essaies contenant l'un des copeaux de cuivre et l'autre de la limaille de fer . la solution d'acide chlorydrique n'agit pas sur les copeaux de cuivre alors qu'elle attaque la limaille de fer .expliquer pourquoi
on donne e0 (h3o+/h2)=0v e0(fe2+/fe)= -0.44v e0(cu2=/cu)=0.34v
à vrai dire j'ai la correction mais vraiment je ne comprends rien .merci infiniment pour avoir soulever mes inquiètudes .
bonsoir,
les potentiels d'oxydoreduction qu'on te donne te montrent que ces couples sont ranges ainsi:
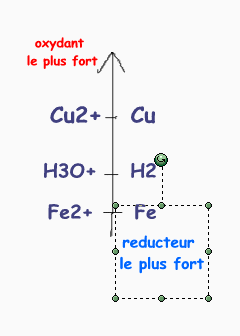
la regle du gamma s'applique et donc la seule reaction possible est :
oxydant le plus fort + reducteur le plus fort ---> oxydant le plus faible + reducteur le plus faible.
tu vois que l'ion cuivre est meilleur oxydant que l'ion H3O+ donc l'acide ne peut pas attaquer le cuivre
carr cu est le reducteur faible et H3O+ l'oxydant faible.
par contre on peut avoir l'action de H3O+ sur Fe pour obtenir des ions Fe2+ et du dihydrogene gazeux.

Bonsoir,
il te suffit de faire la règle du gamma pour constater que H3O+ ne réagit pas avec Cu(2+).
Cordialement,
RLE
mais ce sont bien eux qui permettent de ranger les couples comme ça , la fleche est un axe orienté vers le haut , le zero est celui du couple du milieu. Tu en as un positif au dessus et un negatif au dessous.

slt à tous, j'ai vraiment oublier comment équilibrer l'équation avec h3o+
ex: 2(H+) + Fe ----) Fe 2+ +H2 comment faire en ajoutant h3o+
merci pour l'aide
*** message déplacé ***
Bonjour,
ton équation est bizarre.
Normallement, c'est : Fe = Fe2+ + 2e-
As-tu un énoncé ?
Cordialement.
*** message déplacé ***
bonsoir linwell
cette équation est équlibrée au pt de vu atomes et au pt de vu charges éléctriques:
2H+ + Fe ----> Fe 2+ +H2 on peut y remplacer H+ par H3O+.
un ion oxoniuim H3O+ est l'association d'un ion H+ et d'une molécule d'eau , c.à.d.
H+ +H2O-------> H3O+.
donc * si on remplace 1 H+ par 1 H3O+ on doit ajouter 1 molécule d'eau ds le 2ème membre.
*si on remplace 2 H+ par 2 H3O+ on doit ajouter 2 molécules d'eau ds le 2ème membre.
et ds le cas général :
*si on remplace n H+ par n H3O+ on doit ajouter n molécules d'eau ds le 2ème membre.
voilà comment deviendra notre équation:
2H3O+ + Fe-----> Fe 2+ +H2 + 2 H2O
*** message déplacé ***
bonjour à tous , j'ai de grands problèmes avec cette histoire de réducteur et d'oxydant
voici l'énoncé
une pile est constituée des couples redox suivant pris dans les conditions standards cu 2+/ cu et m 2+/ m.Le couple cu2+/cu est placé à droite et m est un métal inconnu . une lame de métal est attaquée par une solution aqueuse d'acide chlorydrique alors qu'une lame de cuivre ne l'est pas .
svp: quand on dit qu'une lame de métal est attaquée par une solutions aqueuse d'acide chlorydrique qui est le plus réducteur m2+/m ou h3o+/h2??? merciii énormément pour l'aide
1/préciser en justifaint la polarité de la pile
*** message déplacé ***
salut:
Ici l'utilisation de l'attaque des deux métaux par la solution d'acide chlorhydrique est un autre moyen d'identifier la polarité de la pile.
En effet par cette petite expérience on arrivera à classer ces trois couples oxydo -rédox :
car les ions H3O+ de l'acide sont plus oxydant que les ions m+ du métal.
alors que les ions H3O+ de l'acide sont moins oxydant que les ions cu2+ du cuivre.
par conséquence le pole + de la pile sera l'éléctrode de cuivre et celle négative celle du métal.
(le métal est plus réducteur que le cuivre ce qui explique l'oxydation de cette éléctrode )
*** message déplacé ***
Tu as
E°(Cu++/Cu) > E°(H3O+/H2) : le cuivre est moins réducteur que l'hydrogène.
E°(Fe++/Fe) < E°(H3O+/H2) : le fer est plus réducteur que l'hydrogène.
Ainsi cela montre que le fer est attaqué et que le cuivre non.
salut: linwell
à savoir que ds un milieu réactinel lorsqu'il s'agit dr réactions d'oxydo-réduction (ce sont les espèces les plus fortes qui réagissent entre elles)
autrement dit l'oxydant le plus fort réagit avec le réducteur le plus fort.
en effet : ds notre milieu réact. on a mélangé:
H3O+ + métal + cuivre
or le métal est attaqué (c'est lui qui réagit et non pas le cuivre) avec l'oxydant H3O+ et par conséq. il est plus réd.que le cuivre .
on peux le trouver sans utiliser les potentienels d'ox r'dox des 2 couples.
*** message déplacé ***
est ce réagit avec =plus réducteur ? je ne comprends pas
merci pour votre patience
*** message déplacé ***
salut: linwell
en général la réaction entre deux couples oxydo-rédox :
ox1/réd1 et ox2/réd2
se fait ds le sens donnée par 
ds ce cas la réaction s'écrit :
ox1 + réd 2 ---> ox2 + réd 1
tu as bien constaté que laréaction sefait entre l'ox le plus fort et le réd le plus fort .
et que réd 2 qui se trouve ds le 2ème membre est plus réducteur que réd 1 qui est ds le premier membre .
reviens à ton exercice et tu vas bien comprendre.
*** message déplacé ***
slt à tous,j'ai une question débile,merci pour l'aide
si on dit que fe est + réducteur que cu
et cu2+ est plus oxydent que fe2+ alors que dire du couple fe2+/fe plus réducteur ou moins oxydent que cu2+/cu ? (trop débile) au fait je veux comprendre le vrai pourquoi,merci infiniment
*** message déplacé ***
slt à tous,j'ai une question débile,merci pour l'aide
si on dit que fe est + réducteur que cu
et cu2+ est plus oxydent que fe2+ alors que dire du couple fe2+/fe plus réducteur ou moins oxydent que cu2+/cu ? (trop débile) au fait je veux comprendre le vrai pourquoi,merci infiniment
*** message déplacé ***
salut:linwell,RLE, sarriette
en ce qui conserne votre question suivante(que dire du couple Fe2+/Fe plus réducteur ou moins oxydent que cu2+/cu ? ) ça c'est une faute de connaissance.
car on compart un oxydant avec un autre oxydant
et un réducteur avec un autre réducteur .
et non pas un cople ox/réd a
je reprends (car suite à une erreur de tape il s'est posté avant que le fasse)
à savoir q'il y'a une méthode très facile et simple pour comparer les ox et les réducteurs ,dites quantitative.car à chaque couple ox/réd est associé un pontentiel d'oxydo-réduction (en volt) par exemple pour le couple Cu2+/Cu  =0,34V
=0,34V
pour le couple Fe2+/Fe  = -0,44V
= -0,44V
Règle: l'oxydant le plus fort est celui qui appartent au couple dont le potentiel oxydo -rédox est le plus grand . c'est donc Cu2+ qui est plus ox que Fe2+.
Règle: l'e réducteur le plus fort est celui qui appartent au couple dont le potentiel oxydo -rédox est le plus petit . c'est donc Fe qui est plus ox que Cu.
bonne chance .
or il y'a des potentiels postifs et des pot. négatifs on utilise la méthode suivante:
or:  (Cu2+/Cu) >
(Cu2+/Cu) >  (Fe2+/Fe)
(Fe2+/Fe)
alors : Cu2+ est plus ox que Fe
et Fe est plus réd que Cu
en général:
pour plusieurs couples :
le pouvoir oxydant augmente avec l'augmentationdu potentiel d'oxydo rédox
alors que le pouvoir réducteur augmente avec la diminution du potentiel ox réd.


 votre niveau
votre niveau site
site
