Inscription / Connexion Nouveau Sujet
Pile et oxydoréduction
Bonjour, j'ai un exercice dont je n'ai pas le corrigé sur les piles et l'oxydoréduction et je voulais m'assurer avoir bien compris et surtout avoir des précisions car dans certaines de mes réponses je ne suis pas sur de ce que j'ai dit.
On nous donne plusieurs schémas et nous demande de choisir quelles sont les piles fonctionnelles et de détailler les réactions qui y ont lieu et expliquer en détail pourquoi les autres ne le sont pas. Je mets donc les schémas plus bas et voici ce que j'ai écrit :
"1. La pile est fonctionnelle. Du côté de la borne négative, où se situe le zinc, il va y avoir une réaction d'oxydation : Zn -> Zn2+ + 2e-
Du côté de la borne positive, où se site le cuivre, il va y avoir un réaction de réduction : Cu2+ + 2e- -> Cu
On aura donc une réaction d'oxydoréduction : Cu2+ + Zn -> Zn2+ + Cu
L'énergie chimique qui sera dégagée sera transformée en énergie électrique et la pile pourra fonctionner. "
2. A mon sens elle n'est pas fonctionnelle : On a du platine dans une solution de CuSO4 et du zinc dans du NaCl. Mais je ne sais pas quoi exactement ajouter ou comment expliquer...
3. Je pense la pile fonctionnelle. Dans ce cas on aura une réaction d'oxydation: Cu -> Cu2+ + 2 e- , et une réduction : Ag+ +e- -> Ag
On aura la réaction rédox suivante : Cu + 2Ag+ -> 2Ag + Cu2+
4. Le pont salin manquant ne pourra pas assurer l'electroneutralité des solutions, la pile ne fonctionnera pas.
5. La pile n'est pas fonctionnelle, l'argent étant plongé dans une solution de CuSO4 et le cuivre dans une solution d'AgNO3 (en plus si je ne dis pas de bêtise mis dans cet ordre là il serait question de Cu2+ en oxydant et Ag ent réducteur or ce sont pas les oxydants et réducteurs les plus forts et ils ne réagiront pas, mais si je dis une bêtise dites le moi...)
Voilà j'espère pouvoir trouver auprès de vous des réponses plus complètes pour comprendre au mieux le fonctionnement des piles de ce type 
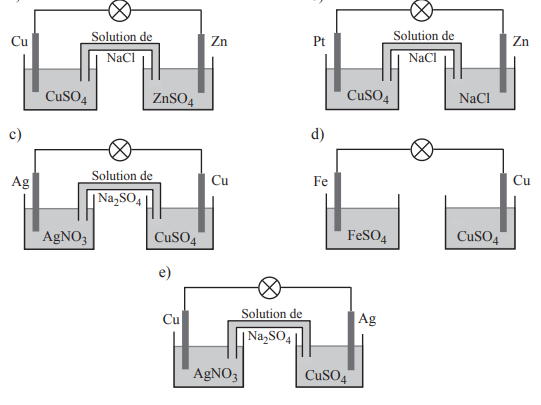
En ce qui concerne les piles 1,3,4,5,tes réponses sont exactes.
A priori je ne vois pas pourquoi la pile 2 ne fonctionnerait pas.
Les ions Cu2+ et le métal Zn bien sont bien présents.
Le bilan global devrait être le même que pour la pile 1 :
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
L'état initial de cette réaction chimique (absence de Cu et de Zn2+) est le même que lorsque on plonge directement un morceau de zinc dans une solution d'ions Cu2+
Le cuivre se dépose sur l'électrode en platine (réputée inattaquable donc pas de réaction secondaire à ce niveau) et les ions Zn2+ passent en solution.
D'accord je vois, en fait peut être que le fonctionnement en lui même n'est pas encore assez clair pour moi. En fait je pensais que pour fonctionner les plaques devaient contenir les éléments qui vont s'oxyder ou se réduire... Mais si la deuxième pile est fonctionnelle alors cela signifie que pour que la pile fonctionne il suffit que les éléments qui vont pouvoir s'oxyder/se réduire soient présents dans les solutions?
Désolée si ce n'est pas très clair mais j'essaie de comprendre au mieux le fonctionnement..
Comme je le disais précédemment, je ne vois pas, à priori, pourquoi la pile 2 ne fonctionnerait pas.
Mais ce n'est pas parce que "je ne vois pas" qu'il ne puisse pas exister une raison pour qu'il en soit ainsi.
Pour moi, dans le cas général, si la réaction chimique est thermodynamiquement possible, que les réactifs sont présents et qu'une chaîne continue de conducteurs existe la pile va fonctionner.
Peut être qu'un chimiste averti peut confirmer ou infirmer ....
Lorsque l'on introduit du zinc dans une solution d'ion la réaction :
se produit spontanément. (Réaction entre oxydant du couple /
et le réducteur réducteur du couple
/
)
Cette réaction peut être effectuée de manière indirecte en réalisant une chaine électrochimique, qui met en contact électronique la solution contenant les ions et une solution saline(
etc...) dans laquelle est plongée le zinc
. Pour cela on utilise un conducteur électronique quelconque
plongé dans la solution qui continent les ions
:
/
//
/
Ce conducteur qui est "la négative" de la chaine électrochimique peut être n'importe quel conducteur électronique. Ici on a du platine mais de l'argent, ou du graphique feraient aussi bien l'affaire.
Lorsque la pile va débiter (dès lors où l'on relie le conducteur au zinc) le cuivre va se déposer sur le conducteur
qui deviendra une électrode en cuivre et la chaine électrochimique fonctionnera alors comme l'association :
/
//
/

 !
!

