Inscription / Connexion Nouveau Sujet
pH, pKa et prédominance dans un couple acide/base
Bonjour,
Je viens ici pour obtenir des éclaircissements par rapport à une question de cours ; j'ai déjà regardé sur le forum des sujets similaires qui ne m'ont pas répondu.
Prenons l'équation suivante de la dissolution d'un acide dans l'eau :
HA + H2O = (A-) + (H3O+)
Je connais l'expression du Ka et voit comment on peut prouver que
pH= pKa + log ([A-]/[HA])
D'après cette définition, je comprends pourquoi telle forme est prédominante quand le pH est inférieur/supérieur au pKa par contre en prenant la première définition du pH que l'on nous a donné, c.a.d
pH = -log [H3O+]
je ne comprend plus. Je m'explique :
En effet, si on considère l'équation du début HA + H2O = (A-) + (H3O+)
je vois que si on suppose que l'acide ne réagit que très peu, il n'y a presque pas d'ions oxonyums formés et par conséquent, le pH sera très élevé et probablement supérieur au pkA
--> normalement la forme basique est prédominante si pH>pKa or dans l'exemple que je vous propose il n'y a presque pas de produit (A-), je ne vois pas comment la forme basique peut prédominer.
Je vous remercie par avance pour votre aide !
Salut,
Dans ton exemple
tu considères mettre en acide dans de l'eau pur donc à pH=7
tu considères que AH réagit peu avec l'eau à pH=7
Donc pKa 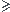 7
7
Donc AH prédominant et [A-] et [H3O+] faibles
Le pH reste élevé mais il n'est pas supérieur au pKa
Merci pour cette première réponse. Pourriez vous faire la même explication avec une situation ou au contraire l'acide réagit assez pour influencer le pH de la solution lors de la dissolution ?
Salut,
Dans ton exemple
tu considères mettre en acide dans de l'eau pur donc à pH=7
tu considères que AH réagit BEAUCOUP avec l'eau à pH=7
Donc pKa 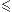 7
7
Donc A- et H3O+ prédominant et [AH] faible
Le pH est acide et il est supérieur au pKa
Exemple : acide fort HCl n'existe pas dans l'eau, je pense que le pKa des acide fort est négatif


