Inscription / Connexion Nouveau Sujet
Ph et pka question
bonsoir ! 
PH = PKA + Log ( [A-]/[HA] )
Si PH = pka ; alors log ( [A-]/[HA] ) = 0 et [ A-] = [ HA]
Mais si PH > Pka , pourquoi on dit que log ( [A-]/[HA] ) >0 ?
idem pour PH < pka , pourquoi on dit que log ( [A-]/[HA] ) < 0 ?
Sinon, lors d'une réaction acido basique, l'équivalence est atteinte quand le PH = pKa .. ( juste ? )
Merci
si Ph > Pka alors PH = PKA + Log ( [A-]/[HA] ) > Pka donc Log ( [A-]/[HA] ) > 0
et vice versa
sinon non
Ah ok merci efpe !
Ah bon .. A quoi correspond l'équivalence alors au niveau du ph et pka ? ( je ne sais pas si ma question a un sens ... )
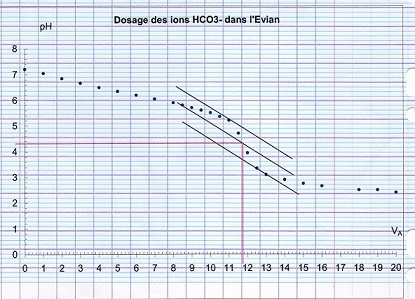
Titrage des ions HCO3- dans une eau minérale :
données : couples et pka : Pka1 (HCO3-/CO3^2- ) = 10,3
PKA2 ( CO2 /HCO3-) = 6,4
PKA (H3O+ / H2O) = 0,0 (j'espère que ce n'est pas une erreur énoncé)
on remplit une burette graduée avec de l'acide chlorhydrique de concentration cA = 0,10mol.l^-1. On introduit Vo = 220ml d'eau Evian mesurées avec une fiole jaugée et un barreau aimanté dans un bécher.On place dans cette eau la sonde du Ph-mètre et on mesure son ph en versant ml par ml la solution d'acide chlorhydrique
voici le graphique obtenu
et après on me demande d'établir le diagramme de prédominance,voici le diagramme qu'on donne dans le corrigé :
Pka1 (HCO3-/CO3^2- ) = 10,3 ; au delà de 10,3 le pH > pka donc la base prédomine . Avant 10,3 c'est l'acide qui prédomine.
Mais pour PKA2 ( CO2 /HCO3-) = 6,4 ; l'acide est Co2 ??
c'est donc normal que CO2 prédomine avant la valeur 6,4 ... Mais j'étais persuadé que HCO3- était un acide
par contre pour l'autre couple c'est bizarre ...

Ah bon .. A quoi correspond l'équivalence alors au niveau du ph et pka ? ( je ne sais pas si ma question a un sens ... )
Comme on l'a dit tout à l'heure, pH = pKa quand [A-] = [HA] donc quand les deux espèces cohabitent en meme quantité ! Ce sont les séparations dans tes diagrammes de prédominance.
Pour répondre à ton problème sur l'autre couple, la solution est en fait que HCO3- est une espèce amphotère, c'est à dire à la fois une base et un acide (mais pas du même couple). D'où tes 3 espèces sur ton diagramme de prédominance en bas.
oui à ph =10,3 [CO3^2-] et [ HCO3-] sont dans les mêmes quantités !
à ph =6,4 ; [CO2] et [ HCO3-] sont dans les mêmes quantités
et H2O sur le diagramme de prédominance .. ?
Comme on l'a dit tout à l'heure, pH = pKa quand [A-] = [HA]
oui, mais tout à l'heure vous m'avez dit que cela ne correspondait pas à l'équivalence ...
je sais comment trouver le PH a l'équivalence sur un graphique mais concrètement je ne comprends pas trop ce qu'il se passe avec toutes ces espèces chimiques ..

ici le dosage s'écrit HCO3- + H3O+ = CO2- + 2H2O
- là on ne parle pas des couples de l'eau sur ton diagramme de prédominance. On a marqué H2O juste pour préciser que CO2 est dissous.
- tout dépend ce que tu appelles équivalence ... pour moi l'équivalence, c'est un terme qui renvoie au dosage. Dans ce cas, non il ne s'agit pas de l'équivalence du dosage quand pH = pKa
- Concrètement, tu as des HCO3- dans l'évian et on verse du H3O+ dedans. Au début de la réaction, on est à pH = 7.2 : en plein dans le domaine de HCO3-, c'est normal. Quand on ajoute des H3O+, on va forcément se déplacer vers des pH plus acides (donc plus bas). Et on forme du CO2
merci !
oui Ici, on dose HCO3- ( qui est une base ) avec la solution titrante d'acide chlorhydrique .
La solution titrante est un acide fort ( l'acide chlorhydrique est toujours un acide fort) et HCO3- est une base faible ( je suppose que c'est une base faible ; mais je ne saurais pas le justifier ... Comment on le justifie d'ailleurs ?? on dit que cette base est peu dissociée dans l'eau ?
Forcément, le Ph sera inférieur à 7 car au fur et à mesure qu'on ajoute de l'acide ; la base dans le bécher diminue . A l'équivalence, HCO3- a disparu ; le PH est donc celui de l'acide chlorhydrique
C'est possible en TS de doser un acide fort ( acide chlorhydrique) par une base faible ? je crois que ce n'est pas au programme , peut-être que je me trompe ...
Pour le titrage acido basique entre acide faible - base forte / et base faible- acide fort j'ai une fiche où c'est noté : PHE(1/2) = pka du couple acido basique concerné
On en a pas parlé en cours...
- pour savoir si c'est une base faible/forte, on te donnera des indices oui (comme le pKa du couple par exemple)
- oui, doser un acide fort par une base faible pourquoi pas. Toutes les combinaisons sont envisageables je pense
- oui c'est un résultat de cours. je t'avoue que je ne saurais pas le réexpliquer mais à la moitié de l'équivalence, tu as autant de la base que de l'acide du couple, donc pH = pKa
merci efpe 
pour savoir si c'est une base faible/forte, on te donnera des indices oui (comme le pKa du couple par exemple)
et comment savoir à partir du pka si c'est un acide fort/faible ou base faible/forte ?
Plus le pKa est bas, plus l'acide se dissocie dans l'eau, et donc plus l'acide est fort.
et vice versa
Ah ok merci  c'est des choses vues il y a quelques mois, ça s'oublie vite quand on ne le revoit plus ...
c'est des choses vues il y a quelques mois, ça s'oublie vite quand on ne le revoit plus ...
Sinon en calculant le taux d'avancement xf/xmax je peux savoir si l'acide ou la base est beaucoup dissociée ou pas ...
Si le taux est de 100%, la réaction est totale, l'acide ou la base en question est dissociée à 100% ( j'ai un doute) ; donc le pka sera très bas.. ?


