Inscription / Connexion Nouveau Sujet
Merci beaucoup, je viens de comprendre qu'il s'agit simplement d'utiliser l'équation de la réaction. J'ai réussi toute une partie toute seule (et grâce à vous!), mais les choses commencent à se compliquer...
On dispose d'une lame de cuivre, d'une lame d'argent, d'une solution concentrée d'acide nitrique, d'une solution de nitrate de sodium, et d'une solution de sulfate de sodium.
On me demande de montrer qu'il est possible à partir des solutions disponibles, de fabriquer une pile...
Je pense qu'une des solutions sert de pont salin, mais pour les demi-piles, je ne sais pas comment procéder. Pourriez-vous m'éclairer?
Il me semble que la question qui m'avait posé problème précédemment doit m'aider...
Je sais qu'une demi pile est constituée des formes oxydées et réduites d'un couple mais je ne dispose pas de ces formes. S'agit-il de les fabriquer?
Merci d'avance pour votre aide si précieuse!
*** message déplacé ***
Bonjour,
Je ne suis pas calé dans ce domaine, ce que je te propose là doit donc être pris avec précaution. Il ne s'agit pas de le considérer comme la solution. Ce sont seulement des idées qui peuvent peut-être t'aider.
Voici un propos que j'ai recueilli sur le site http://e.m.c.2.free.fr/piles.htm
« La réaction d'oxydoréduction spontanée entre deux couples s'effectue toujours entre le réducteur le plus fort et l'oxydant le plus fort (règle dite "du gamma"). »
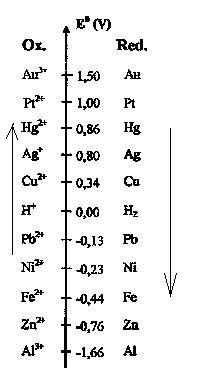
Sur ce site se trouve aussi le tableau joint, où l'on voit qu'entre Ag+ et Cu+, l'oxidant le plus fort est Ag+, c'est l'ion qui est en solution dans notre échantillon.
On y voit aussi qu'entre Cu et Ag le réducteur le plus fort est Cu.
Il y aurait donc réaction entre Cu et Ag+ si l'on trempait la lame de Cu dans la solution d'Ag+.
Pour fabriquer la pile je pense qu'on pourrait tremper la lame d'argent dans la solution d'Ag+ pour faire la première demi-pile.
Pour la deuxième demi-pile j'aurais trempé la lame de cuivre dans une solution de sulfate de cuivre (mais l'énoncé donne une sulfate de sodium, est-ce une erreur ?), à moins que l'on ne fabrique une solution d'ions Cu+ dans un autre échantillon d'acide nitrique concentré pour obtenir une solution de nitrate de cuivre et y plonger la lame de cuivre.
J'aurais utilisé le nitrate de sodium comme pont salin.
Tout ceci est incertain. Il faudrait que quelqu'un qui connaisse bien la question donne quelques précisions. Car je touche là les limites de ma connaissance en la matière.
Bonne chance.
*** message déplacé ***
Merci, ce sont déjà là quelques idées qui m'aident bien. J'ai d'ailleurs aussi pensé à l'erreur d'énoncé quand à la solution de sulfate de sodium, car j'ai lu que le sulfate de suivre est souvent utilisé dans la fabrication des piles.
Je m'y remets après avoir fait un tour sur ce site, merci encore!
*** message déplacé ***
Petite question concernant une réaction
Bonjour!
J'ai une petite question de chimie.
Le cuivre réagit-il avec le sulfate de sodium? Si oui, l'espèce formée se dépose-t-elle sur la lame ou les copeaux de cuivre? Et d'ailleurs, quelle serait l'espèce formée??
Merci beaucoup
Salut!
Selon moi, du cuivre métallique ne peut pas réagir avec Na2SO4, ça me semble très improbable...
Salut!
En fait, je dois déterminer quelle espèce réagit avec le cuivre en laissant un dépôt sur la lame de cuivre ou les copeaux de cuivre.
J'ai le choix entre l'acide nitrique, le nitrate de sodium et le sulfate de sodium. J'ai déjà éliminé l'acide nitrique, car il me semble que la réaction ne provoque pas de dépôt sur la lame de cuivre... J'élimine donc également le sulfate de sodium... Est-ce possible avec le nitrate de sodium?
Pourriez vous m'éclairer?
Tu réalises quoi au juste comme réaction (type de réaction)?
La réaction entre le cuivre et l'acide nitrique produit un gaz roux (dioxyde d'azote je crois) et la solution se colore en bleu. Je ne sais pas si des dépôts se forment mais c'est possible puisque il est attaqué...
Le cuivre n'est pas attaqué par le nitrate de sodium car l'ion nitrate n'attaque pas le cuivre...
C'est une réaction d'oxydoréduction. Le seul indice que j'ai est qu'il se forme un dépôt sur la lame de cuivre... Je vais essayer de voir si ça fonctionne avec l'acide nitrique.
En fait, c'est pour la fabrication d'une pile. Une des solutions servira également de pont salin.
Rha ben voila il fallait préciser dans quel cadre s'inscrivait cette réaction...
Le pont salin est constitué d'un tube en U creux rempli d'une solution gélifiée conductrice concentrée (ou d'une simple feuille de papier). Les ions présents dans le pont salin (en général K+ et Cl- ou NO3-) n'interviennent pas dans la réaction d'oxydoréduction qui est la source de l'énergie électrique. On dit qu'ils sont chimiquement inertes. Leur rôle est d'une part de permettre le passage du courant dans la pile et d'autre part d'assurer la neutralité électrique des solutions.
Tu peux par exemple réaliser une pile au cuivre et au zinc: elle est réalisée en associant par un pont salin deux demi-piles. L'une est constituée d'un bécher contenant une solution de sulfate de cuivre(II) dans laquelle trempe une lame de cuivre et l'autre es constituée d'un bécher contenant une solution de sulfate de zinc dans laquelle trempe une lame de zinc.
Pour toi une électrode est en cuivre et l'autre?
En fait, j'ai déjà trouvé comment réaliser l'autre demi-pile en trempant une lame d'argent (c'est l'autre électrode) dans une solution d'acide nitrique. J'obtiens alors bien des ions Ag+ qui font parti de la solution électrolyte de cette demi pile. La demi pile est alors constituée d'un bécher contenant une solution avec des ions Ag+ dans laquelle on trempe la lame d'argent.
J'utiliserai donc le nitrate de sodium pour le pont salin selon toi? Il ne me resterai plus que la solution de sulfate de sodium dans laquelle je tremperai la lame de cuivre...
Je ne savais pas qu'on pouvait utiliser un tube en U pour le pont salin, c'est ce que je vais faire.
Merci beaucoup
Ok, merci c'est super sympa! Donc le sulfate de sodium doit réagir avec le cuivre... Et ça donnerai quoi?
C'est de cette forme:
A la borne négative il se produit l'oxydation du réducteur 1: Red1 = Ox1 + n1e-
A la borne positive il se produit la réduction de l'oxydant 2: Ox2 + n2e- = Red2
Le bilan électrochimique est alors: Red1 = Ox1 + n1e- * n2
Ox2 + n2e- = Red2 * n1
---------------------------------------------------------------------------------------------------
n2Red1 + n1Ox2 = n2Ox1 + n1Red2
D'accord, je crois que pour ce cas particulier l'équation représentant le fonctionnement de la pile est:
2Ag+ + Cu = 2Ag + Cu2+
Mais qu'en est-il de la demi pile au cuivre? Y-a-t-il effectivement des ions Cu2+ qui se forment?



