Inscription / Connexion Nouveau Sujet
nomenclature phosphore
Bonjour,
Pourriez vous m'expliquer pourquoi le phosphate de manganèse c'est MnHPO4 et non Mn3(PO4)2 svp?
Il y a du H3PO2, H3PO3, H3PO4 mais pourquoi on garde une fonction acide de PO4 avec le manganèse?
Merci !
La formule du phosphate de manganèse est bien comme tu le dis Mn3(PO4)2
MnHPO4 est la formule de l'hydrogénophosphate de manganèse.
Voici en fait le QCM auquel je n'avais pas bien répondu. Le phosphite de manganèse n'est pas Mn3(PO3)2 ?
P.S. désolée je m'étais trompée tantôt en posant la question de "phosphate" c'était phosphite que je voulais dire…
Quelle est la formule brute du phosphite de manganèse ?
MnPO3
Mn2(PO3)2
Mn3(PO3)3
MnHPO3
Mn(H2PO3)2
L'ion phosphite (HPO3)2- s'associe avec l'ion Manganèse Mn2+ pour former du phosphite de manganèse MnHPO3
Attention de ne pas confondre l'ion phosphate (PO4)3- dérivé de l'acide phosphorique H3PO4 avec l'ion phosphite (HPO3)2- dérivé de l'acide phosphoreux H3PO3
Contrairement à l'acide phosphorique qui est un triacide, l'acide phosphoreux malgré les apparences est un diacide
Les couples acido/basique sont :
H3PO3 / (H2PO3)-
(H2PO3)- / (HPO3)2-
Le 3e atome d'hydrogène directement relié à l'atome central (P) n'est pas ionisable et l'ion (PO3)3- n'existe pas
Désolé, je ne comprends pas ta question.
Le "Ça ne fonctionne pas" me laisse perplexe qu'est ce qui ne "fonctionne pas" ?
Les acides sulfuriques et les acides phosphoriques ?
A ma connaissance il n'existe qu'un seul acide sulfurique H2SO4 et qu'un seul acide phosphorique H3PO4
Oui, excusez moi, je me suis mal exprimée.
La chose que je voulais dire c'est que les acides sulfuriques n'ont pas le soufre non ionisable, c'est bien ça? On peut avoir H2SO4, ensuite HSO4- et finalement SO4 2-, c'est bien ça?
Or pour les acides phosphoriques, il y a un atome de phosphore qui est non ionisable.
C'est correct comme ça? 
Or pour les acides phosphoriques, il y a un atome de phosphore qui est non ionisable.
C'est correct comme ça?
Non : Il n'a jamais été question d'atome de phosphore ionisable !
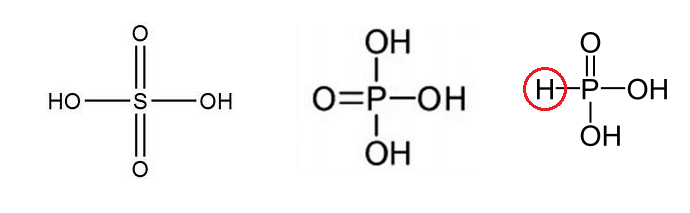
L'acide sulfurique H2SO4 est un diacide.
Par pertes successives d'un ion H+ il devient HSO4- puis SO42-
L'acide phosphorique H3PO4 est un triacide.
Par pertes successives d'un ion H+ il devient H2PO4- , HPO42- puis PO43-
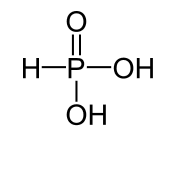
L'acide phosphoreux H3PO3 est un diacide.
Par pertes successives d'un ion H+ il devient H2PO3- puis HPO32-
Dans les deux premiers acides les atomes d'hydrogène ne sont pas liés à l'atome central : ils sont ionisables.
Dans le dernier acide un des atomes d'hydrogène ( cerclé en rouge sur mon schéma) est directement lié à l'atome central : Il n'est pas ionisable.
Merci beaucoup pour ces schémas !! Mais alors pour l'acide hypophosphoreux, l'atome d'hydrogène n'est pas non plus ionisable, si? j'ai vu sur internet qu'un atome d'hydrogène est directement lié à l'atome de phosphore
L'acide hypophosphoreux H3PO2 possède trois atomes d'hydrogène dont un seul est ionisable. C'est un monoacide.
D'accord ! Pour etre sur, quand vous dites "triacides, diacide, monoacide", cela veut bien dire que par exemple pour l'acide phosphorique, H3PO4 qui est un triacide, il peut perdre 3 fois le proton H+ ? Il a trois fonctions acides? C'est comme ça qu'on dit?



