Inscription / Connexion Nouveau Sujet
Mise en solution d'un gaz, 2 petites questions
Bonjour j'ai un petit exercice que je n'arrive pas a faire. Voici l'enoncé et les questions
La molécule de chlorure d'hydrogène est une molécule polaire. Sa mise en solution dans l'eau permet d'obtenir une solution aqueuse d'acide chlorhydrique.
1. Expliquer la polarité de la molécule de chlorure d'hydrogène
2. Qu'appelle-t-on phénomène de solvatation des ions en solutions aqueuse ?
3. Ecrire l'équation de dissolution du chlorure d'hydrogène gazeux.
Pour les 2 prmières questions je sais pas du tout
Pour la 3 : HCl(?)  H+(?) + Cl-(?)
H+(?) + Cl-(?)
Si quelqu'un pourrait m'aider svp !! Merci d'avance 
Salut !
1) il faut que tu considères l'electronégativité de H et de Cl
2) ce sont les molécules d'eau qui entourent les ions (voir l'image)
3) il faut mettre (g) pour HCl, et (aq) pour H+ et Cl-
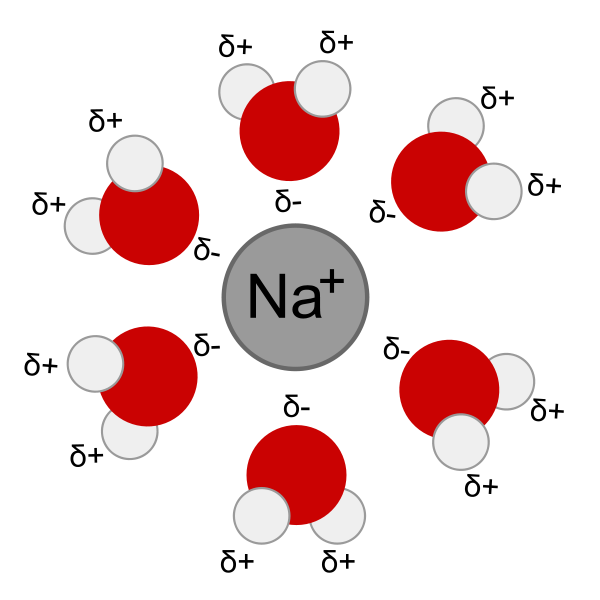
Est ce que tu peux expliqué en gros ca veut dire quoi qu'un molécule est polaire ?  je comprends pas trop..
je comprends pas trop..
Et tu veux dire quoi par considérer l'electronégativité de H et de Cl ?
Non j'ai un dm pendant les vacances on fera certainement le cours après.. En tout cas je suis complètement perdue!
Alors petit cours rapide :
l'électronégativité d'un élément mesure sa tendance à attirer les électrons des liaisons qu'il fait avec d'autres éléments.
Dans le tableau, tu vois que Cl est bcp plus électronégative que H (car situé bcp plus à droite dans le tableau). Cela veut dire que dans la liaison H-Cl, les électrons ne sont pas partagés équitablement mais sont plutôt du côté de Cl. La conséquence est qu'il y a un excès d'électron du côté de Cl et un défaut du côté de H. Du coup la molécule a un pôle - du coté de Cl et un pôle + du côté de H (alors que la molécule reste toujours neutre bien sûr). On dit alors qu'elle est polarisée, comme un aimant (sauf que ce sont des poles électriques et pas magnétiques)




