Inscription / Connexion Nouveau Sujet
Mesure en Chimie.
Alors tout d'abord coucou tout le monde 
J'ai des difficultés sur certaines questions d'un dossier d'exercice sur la qualité de l'eau a Nice. On a deux fiches, une fiche qui présente un peu sur quoi l'eau est contrôle et puis une autre fiche avec des questions 
La fiche sur l'eau n'est pas nécessaire pour répondre aux questions 
Voici l'énoncé et les questions :
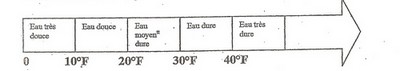
- La dureté de l'eau s'exprime par le degré hydrotimétrique ( TH ) mesuré en degré français (°F). TH(°F) = 10 C avec C : concentration molaire totale en ions calcium et magnésium en mmol.L-1
Plus le TH est élevé, plus l'eau est " dure " . La consommation d'une eau moyennement dure contribue a satisfaire nos besoins en calcium et magnésium.
a ) Ecrire les structures électroniques des atomes de calcium et de magnésium. Rappeler la règle de stabilité ( octet ou duet ) et en déduire les formules les formules des ions calcium et magnésium sachant que Z(Ca)=20 et Z(Mg)=12
Ma réponse : On prendra la regle de stabilité de duet qui convient a cette situation qui dit : un atome ayant Z > 4 tend a perdre ou gagné des électrons de façon a avoir 8 électrons de sa couche de valence, pour ainsi avoir la meme configuration électronique qu'un gaze rare.
Z(ca)=20 le gaz rare le plus proche est Z(Ar)=18 donc Ca2+
Z(Mg)=12 le gaz rare le plus proche est Z(Ne)=10 donc Mg2+
b) Quelle est la quantité ( en mol ) de calcium dans 40mg d'ions calcium ?
quelle est la quantité ( en mol ) de magnésium dans 24mg d'ions magnésium ?
- A ce niveau je sèche car je vois pas comment il faut procédé..
c) Quel serait le degré hydrotimétrique d'une eau contenant 40mg d'ions calcium et 24mg d'ions magnésium dans un litre? sachant que M(Ca)=40g.mol-1 et M(Mg)=24.3g.mol-1
- la non plus je sais pas comment procédé, bon j'ai commencé par la formule C=N*V sachant que n=m/M ( et la je sais pas s'il faut ajouter la masses des deux ions et ajouter la masse molaire des deux ions )
Voila avec l'aide a ces questions je pense finir le reste de l'exercice 
Merci d'avance a ceux qui prendront le temps et me répondront!
Bon soir!
b) Quelle est la quantité ( en mol ) de calcium dans m(Ca)=40mg d'ions calcium ?
quelle est la quantité ( en mol ) de magnésium dans m(Mg)=24mg d'ions magnésium ?
------------------------------
n(Ca)=m(Ca)/M(Ca)=40*10^(-3)/40=1,0 mmol
n(Mg)=m(Mg)/M(Mg)=24*10^(-3)/24.3=0,99 mmol
------------------------------
c) Quel serait le degré hydrotimétrique d'une eau contenant 40mg d'ions calcium et 24mg d'ions magnésium dans un litre? sachant que M(Ca)=40g.mol-1 et M(Mg)=24.3g.mol-1
-------------------------------
[Ca^2+]=1/1=1,0 mmol/L
[Mg^2+]=0.99/1=0.99 mmol/L
degré hydrotimétrique ( TH ) mesuré en degré français (°F). TH(°F) = 10 C avec C : concentration molaire totale en ions calcium et magnésium en mmol.L-1
(TH) de l'eau =1,99*10=19,9 °F (degré hydrotimétrique français)
-------------------------------




