Inscription / Connexion Nouveau Sujet
Lumières colorées - Exploiter un diagramme de niveaux d'énergies
Le diagramme ci-contre représente certains niveaux d'énergie de l'atome de lithium.
E0=-5.39 ; E1=-3.54 ; E2=-2.01 ; E3=1.55 ; E4=-1.51
La raie rouge du spectre de la lumière émise par une lampe à vapeur de lithium correspond à la transition du niveau d'énergie E1 vers le niveau d'énergie E0.
1. Calculer l'énergie du photon correspondant en électronvolt, puis en joule.
2. En déduire la valeur de la longueur d'onde dans le vide de la radiation associée. Vérifier qu'elle correspond bien à une radiation rouge.
Données: c=3,00×108 m.s−1; 1eV=1,60×10−19 J; h=6,63×10−34 J.s.
Je ne sais pas trop quel niveau d'énergie calculer. Je sais que E(en J) = h (6.63*10-34)*  (enHz)
(enHz)
Merci d'avance pour toute votre aide 
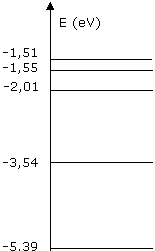
E1=-3,54 et E0=-5,39.
Pour passer de E1 a E0, l'atome de lithium perd donc 1,85 electron-volt. (-3,54-(-5,39))=1,85.
Si l'atome de lithium perd de l'énergie, alors cela signifie qu'il émet de l'énergie (car l'énergie doit toujours être conservée) en libérant un photon. Donc l'énergie de ton photon est 1,85 eV.
ensuite tu fais 1,85x1,60x10^-19=2,96x10^-19 J
Ainsi, tu trouves l'energie du photon en joules.
normalement tu dois avoir vu la formule E=hc/
donc =hc/E
=hc/E
donc  =(6,63x10^-34x3,00x10^8)/2,96x10^-19=6,72x10^-7 metres =672 nanomètres.
=(6,63x10^-34x3,00x10^8)/2,96x10^-19=6,72x10^-7 metres =672 nanomètres.
Tu regardes ensuite où se situe 672 nanometre sur le spectre du visible et tu constates que cette longueur d'onde correspond bien à une lumiere rouge comme l'énoncé l'affirme.


