Inscription / Connexion Nouveau Sujet
loi de beer lambert et pourcentage massique
Bonsoir,
Pourriez vous me dire si ma résolution de l'exercice est correcte ?
MERCI !!
ÉNONCÉ DE L'EXERCICE
La pièce de 10 centimes d'euro est composée d'un alliage, dit alliage nordique,comportant du cuivre, de l'aluminium, du zinc et de l'étain. On cherche, par une méthode de spectrophotométrie, à déterminer la teneur massique en cuivre d'une telle pièce. Sa masse totale est de 4,1 g.
Le cuivre, de masse molaire 63,5 g.mol-1, est un métal qui peut être totalementoxydé en ions cuivre (II) par un oxydant puissant tel que l'acide nitrique selon la réaction d'équation :
3 Cu(s) + 8 H+(aq) + 2 NO3-(aq) 3 Cu2+(aq) + 4 H2O(l) + 2 NO(g)
Tout le cuivre se retrouve sous forme d'ions cuivre (II) intégralement dissous en
solution.
En pratique, on dépose une pièce de 10 centimes dans un erlenmeyer de 250 mL
et on verse de l'acide nitrique concentré, sous la hotte, en excès. Ensuite, on transfère le contenu dans une fiole jaugée de 1,000 L, et on complète jusqu'au
trait de jauge avec de l'eau distillée. On obtient une solution S.
On mesure l'absorbance A de cette solution S pour une longueur d'onde de 800 nm : seuls les ions cuivre y contribuent.
On trouve A = 0,85
On a par ailleurs préparé une gamme de solution de sulfate de cuivre étalon.
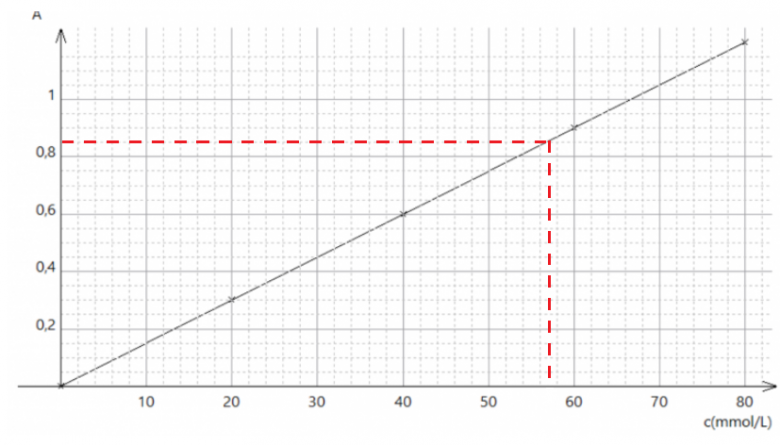
L'absorbance A est proportionnelle à la concentration c en ions cuivre : (graphique joint en PNG)
Déterminer la concentration en ions cuivre de la solution S et en déduire le pourcentage massique de cuivre dans la pièce. ( défini comme le rapport entre lamasse de cuivre et la masse de la pièce)
MA RÉSOLUTION :
D'après le graphique C = 60mmol/L OU 60 x 10-3 mol/L CAR A 0,85
POURCENTAGE MASSIQUE:
n = m/M = 4,1 x 63,5 = 6,5 x 10 -2 mol
Pourcentage = 6,5 x 10 -2/4,1 = 16%
Pourriez vous s'il vous plaît corriger mes erreurs cela m'aiderai beaucoup. MERCI à vous !
Bonsoir,
Je conseille la marche suivante :
a) Absorbance de la solution (voir énoncé)
b) A partir du graphique : Concentration molaire de la solution
c) Volume de la solution (voir énoncé)
d) Quantité de matière en cuivre de la solution
e) Masse du cuivre contenu dans la solution ( donc égale à la masse du cuivre contenu dans la pièce de 10 centimes
f) Comparaison entre le résultat de e) et la masse de la pièce
g) Calcul du pourcentage.
odbugt1 Bonsoir,
J'ai essayé de suivre votre méthode mais je bloque à la e)...
a) A= 0,85
b) Cmolaire = 60 mmol/L = 60 x 0,001 = 0,06 mol
c) Vsol = 1,000L
d) n = C x V = 0,06 x 1,000 = 60 mol
e) mpièce = 4,1g d'après l'énoncé
après j'arrive plus
Reprenons :
a) A = 0,85
b) Cmolaire = 57 mmol/L = 57 x 0,001 = 0,057 mol /L
c) Vsol = 1,000L
d) n(Cu) = Cmolaire x V = 0,057 x 1,000 = 0,057 * 1 = 0,057 mol
e) La masse de cuivre présente en solution (donc présente dans la pièce de monnaie) s'obtient à partir du résultat précédent ( en d ) et de la masse molaire atomique du cuivre.
Je te laisse poursuivre ....
odbugt1 aah d'accord donc j'ai poursuivie et j'ai trouvé :
e) m (Cu) = n(Cu) x M(cu) =0,057 x 63,5 = 3,6 g
F) Il y a donc 3,6 g de cuivre dans la pièce et 0,5 g d'autre chose
g) Pourcentage = 3,6/4,1 x 100 = 87 %
Est-ce que j'ai bien fais cette fois-ci ?
Presque !
Attention aux arrondis en cours de calcul :
e) m (Cu) = n(Cu) x M(cu) =0,057 x 63,5 = 3,6195 g
g) Pourcentage = (3,6195 / 4,1) x 100 = 88,28%  88%
88%
odbugt1 aah super Merci. J'avais arrondi parce que on arrête pas de nous répéter "attention aux chiffres significatifs" du coup voilà mais je ferais plus attention. Merci de m'avoir accordé de votre précieux temps.
Bien à vous,
une élève perdu 
DEBOA
J'ai pas compris cette ligne (en gras)
d) n(Cu) = Cmolaire x V = 0,057 x 1,000 = 0,057 * 1 = 0,057 mol
Cmolaire x V = 0,057 x 1,000 = 0,057 ??
Les réponses aux questions posées doivent être arrondis avec un nombre correct de chiffres significatifs.
En revanche les calculs doivent être menés avec un maximum de chiffres significatifs.