Inscription / Connexion Nouveau Sujet
les réaction acido-basique
Bonjours je suis bloquer a la question 2 du devoir et je ne peut pas poursuivre le devoir sans la question
Mes réponse que question précédente sont PH=pKa+log([HCO3[/sup]-] / [CO[sub]2,H2O]
Merci d'avance pour votre aide
** image supprimée ** 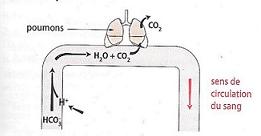
** énoncé effacé ; image laissée **
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]()
J'ai un Dm a faire mais depuis 3 jours je suis bloqué a partir de la question 2
Le << Tampon bicarbonate >> intervient dans l'équilibre acide-base du sang par le couple CO2(aq), H2O (l)/HCO3- (aq). il présente l'avantage important de pouvoir fonctionner en système ouvert, c'est a dire relié à l'exterieur, les concentrations en base et en acide pouvant être régulées par contrôles de leurs excrétions ( CO2 par voie respiratoire et HCO3- par voie renal(e))
On cherche à illustrer le rôle du tampon bicarbonate et ses rapports avec la respiration. on considéra que les concentrations dans le sang sont 24mmol/l pour les ions HCO3-(aq) et de 1.2 mmol/l pour le CO2(aq).
1)a: Ecrire la relation entre le pH et le pKa du couple acide-base CO2,H2O(l)/HCO3-(aq)
Mon résultat : pH=pKa+log ([HCO3-/[CO2,H2O])
b: Effectuer l'application numérique
Mon résultat : pH=7.40
L'Équation de la réaction qui se produit si un excès d'acidité arrive dans le sang est : H++HCO3-(aq) <--> CO2(aq)+H20 (l)
On considère un apport dans le sang de 2.0mmol/l d'ions H- (aq)
2)a: Quelles sont les nouvelles concentrations molaire en HCO2-(aq) et de CO2(aq) si l'on est en système fermé, c'est a dire isolé de l'extérieur?
b: Que deviens le PH?
3) En système ouvert, il y a élimination du CO2 en exès par voies respiratoire.
a:Que peut-on dire de la concentration molaire de CO2 en excès par voies respiratoire.
b: Calculer la valeur du pH en système ouvert et la comparer à celle en système fermé
4) Dans quel cas le tampon bicarbonate du sang est-il le plus afficace
Donné pka( CO2(aq), H2O(l)/HCO3-(aq)) = 6.1
Merci d'avance de votre aide
*** message déplacé ***
J'ai un Dm a faire mais depuis 3 jours je suis bloqué a partir de la question 2
Le << Tampon bicarbonate >> intervient dans l'équilibre acide-base du sang par le couple CO2(aq), H2O (l)/HCO3- (aq). il présente l'avantage important de pouvoir fonctionner en système ouvert, c'est a dire relié à l'exterieur, les concentrations en base et en acide pouvant être régulées par contrôles de leurs excrétions ( CO2 par voie respiratoire et HCO3- par voie renal(e))
On cherche à illustrer le rôle du tampon bicarbonate et ses rapports avec la respiration. on considéra que les concentrations dans le sang sont 24mmol/l pour les ions HCO3-(aq) et de 1.2 mmol/l pour le CO2(aq).
1)a: Ecrire la relation entre le pH et le pKa du couple acide-base CO2,H2O(l)/HCO3-(aq)
Mon résultat : pH=pKa+log ([HCO3-/[CO2,H2O])
b: Effectuer l'application numérique
Mon résultat : pH=7.40
L'Équation de la réaction qui se produit si un excès d'acidité arrive dans le sang est : H++HCO3-(aq) <--> CO2(aq)+H20 (l)
On considère un apport dans le sang de 2.0mmol/l d'ions H- (aq)
2)a: Quelles sont les nouvelles concentrations molaire en HCO2-(aq) et de CO2(aq) si l'on est en système fermé, c'est a dire isolé de l'extérieur?
b: Que deviens le PH?
3) En système ouvert, il y a élimination du CO2 en exès par voies respiratoire.
a:Que peut-on dire de la concentration molaire de CO2 en excès par voies respiratoire.
b: Calculer la valeur du pH en système ouvert et la comparer à celle en système fermé
4) Dans quel cas le tampon bicarbonate du sang est-il le plus afficace
Donné pka( CO2(aq), H2O(l)/HCO3-(aq)) = 6.1
Merci d'avance de votre aide
*** message déplacé ***


