Inscription / Connexion Nouveau Sujet
Les energies + alcool alcanes
Bonjour, J'ai un DM pour la rentré et je n'ai pas tous compris j'aimerais avoir quelque explication :
Un véhicule 4*4 consomme 0.135 L d'essence par kilomètre.
Ce carburant est un mélange complexe d'alcanes, principalement des molécules comportant 8 atomes de carbone ( de formule brute C8h18).
Un avion moyen ( 300 passagers) consomme quant à lui 14 L de kérosène par kilomètre. Il s'agit également d'un mélange complexe d'alcanes, principalement des molécules comportant 11 atomes de carbone ( de formule c11h24).
Donnés : Densité de l'essence et du kérosène :
0.74 0.80
1) Écrire la formule développée des alcanes linéaires constitués de 8 et 11 atomes de carbone
h h h h h h h h
h-c-c-c-c-c-c-c-c-h Je n'en fait qu'une c'est le même système pour l'autre.
h h h h h h h h
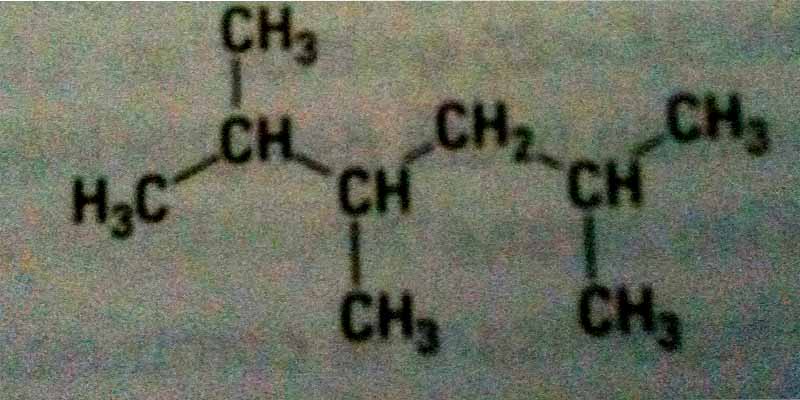
2) Nommer le composé ci dessous :
J'ai mis cela 2-3-5 trimethylhexane
3) Es un isomère de l'octane ?
Non car il à possède 20 hydrogène contre 18 chez l'octane.
4)les moteurs des moyens de transport décrits ci-dessus utilisent l'énergie libéré lors de la combustion des alcanes constituant le carburant.
Écrire les équations modélisant la combustion des principaux composant de l'essence et du kérosène.
CnH2n+2 + O2  CO2 +H2O Il faudrait confirmer cet équation.
CO2 +H2O Il faudrait confirmer cet équation.
Je c'est qu'il y a de l'octane dans l'essence mais je vois pas quoi mettre.
5) Déterminer la quantité de matière consommée par kilomètre parcouru pour chacun des moyens de transport.
µe.d.V(X)
n(essence)= ------------ µe: masse volumique de l'eau en kg.m-3 ou en g.cm-3
M(X) M(X): masse molaire de l'espèce X en kg.mol-1 ou en g.mol-1
1*0.74*0.135
n(essence) = ------------ = 8.76E-04 Je ne suis pas sur du 114 : C8H18 : 12*8+18 = 114 g/mol
114
n(kérosène) = 1*080*14
----------- = ? Je n'ai pas trouver de masse molaire pour le kérosène.
?????
6) D'après les équations de la questions 4, quelles sont les masses de CO2 formé par kilomètre parcouru pour chacun des moyens de transport ?
Je ne c'est donc pas vu que je n'ai pas les équations
7) a. Quelles est la masse du dioxyde de carbone produit par personne lors d'un trajet aller-retour Paris-marseille, effectué par deux personne dans un 4*4 à essence ?
Même question pour un avions embarquant 300 passagers ?
b.Lequel des deux moyens de transport minimise l'émission de dioxyde de carbone ?
Même si on a pas la solution du 7.a je dirais le 4*4
Merci pour votre aide cela m'a pris du temps de tout rédiger 
Bonsoir,
Pour la 1 ==> OK
Pour la 2 ==> je dirais 2,3,5-methylhexane
Pour la 3 ==> le composé dont on donne la formule semi-développée a pour formule brute C9H20 et l'octane a pour formule brute C8H18. Ils n'ont pas la même formule brute. Ils ne peuvent pas être isomères.
Pour la 4 ==>
Pour l'essence, le composant principal est l'octane
2 C8H18 + 25 O2  16 CO2 + 18 H2O
16 CO2 + 18 H2O
Pour le kérosène, le composant principal est un composé chimique de formule brute C11H24
C11H24 + 17 O2  11 CO2 + 12 H2O
11 CO2 + 12 H2O
Pour la 5 ==> la masse molaire de l'octane est bien 114 g.mol-1.
Mais tu mélanges allègrement les kilogrammes et les grammes...
1 0,74
0,74 0,135 donne une masse en kg et tu divises par la masse molaire en g. Le chiffre 1 représente la masse volumique de l'eau : 1 kg.L-1 ou 1 g.cm-3.
0,135 donne une masse en kg et tu divises par la masse molaire en g. Le chiffre 1 représente la masse volumique de l'eau : 1 kg.L-1 ou 1 g.cm-3.
Mais il faut être cohérent. Comme tu multiplies par 0,135 L, cela donne kg.L-1 L donc on obtient des kg (la densité est sans dimension).
L donc on obtient des kg (la densité est sans dimension).
Donc, pour la masse des 0,135 L, il faut utiliser 1000 g.L-1.
1000 0,74
0,74 0,135 et on obtient des g que l'on peut diviser par la masse molaire en g :
0,135 et on obtient des g que l'on peut diviser par la masse molaire en g :
Je ne vois pas pourquoi la masse molaire du kérosène C11H24 te pose un problème...
M kérosène = (12  11) + (1
11) + (1  24) = 132 + 24 = 156 g
24) = 132 + 24 = 156 g
Et :
Jusque là, ça va ?...
Je ne peux pas laisser passer
Je ne c'est donc pas vu que je n'ai pas les équations
C'est à la fois un contresens et un non-sens... C'est le verbe "savoir" pas le verbe "être"...
==> Je ne sais donc pas vu que je n'ai pas les équations
oui merci bien excusez pour cette faute.
Oui jusqu'à la je comprends bien c'est la suite de l'exercice je ne vois pas la méthode à utiliser ?
Comment calculer t'ont la masse de CO2 formé
Et la question 7.
Pour la 6
D'après l'équation, pour l'octane, tu sais que, pour 1 mole de C8H18, on obtient 8 moles de CO2 (pas besoin d'un tableau d'avancement).
Comme on a 0,876 mole de C8H18, on a 8 fois plus de CO2 ==> 7,01 moles.
Connaissant la masse molaire du CO2 (MCO2 = 44 g), on a 44 7,01 g de CO2 pour un km en 4
7,01 g de CO2 pour un km en 4 4.
4.
Même principe pour le kérosène...
Pour la 7, il faut connaître la distance Paris-Marseille par la route d'une part, et la distance Paris-Marseille par avion d'autre part. Sauf erreur de ma part, on n'a pas ces informations dans l'énoncé que tu as écrit...
Merci bien la distance paris Marseille n'est pas donner elle n'est noter nulle part
Je ne c'est pas vraiment si je doit la prendre moi me^me pouvais vous me monter le calcul avec une distance approximative svp 
Je ne c'est pas vraiment si je doit la prendre
==> Je ne sais pas vraiment si je dois la prendre
Oubli regrettable dans l'énoncé...
On va prendre 800 km par la route et 700 km par avion. Cela doit être assez proche de la vérité bien que avec les couloirs aériens, je ne sais pas trop...
Par la route, cela fait donc 1600 km (aller-retour).
A raison de 308 g de CO2 par km, on a donc 308
 1600 g de CO2 pour Paris-Marseille avec un 4x4. Mais il y a 2 personnes à bord et on demande la masse de CO2 par personne donc
1600 g de CO2 pour Paris-Marseille avec un 4x4. Mais il y a 2 personnes à bord et on demande la masse de CO2 par personne donc Même chose pour le kérosène... avec les bons nombres (300 passagers, etc...) !!
Tu peux mettre tes résultats si tu veux que je vérifie...
Moi aussi, je fais des fautes...
Cela doit être assez proche de la vérité bien que avec les couloirs aériens, je ne sais pas trop...
==> Cela doit être assez proche de la vérité bien que, avec les couloirs aériens, je ne sache pas trop...
subjonctif après "bien que"...
je vous avoue que je suis pas en forme mais d'où sort le 308 g de CO2 par km car faut que j'explique comment j'ai cette valeur ?
j'oubliais pour la questions 5 5) Déterminer la quantité de matière consommée par kilomètre parcouru pour chacun des moyens de transport. on a juste determiner une quantiter de matière mais on ne l'a pas fait par kilomètre parcouru non ?
d'où sort le 308 g de CO2 par km
On a vu qu'il y avait 7,01 mol de CO2 par km pour le 4x4 (message posté le 19-04-12 à 13:32).
308 g de CO2, ça correspond à 7,01 mol de CO2 (44
 7,01).
7,01).
Dans le message posté le 18-04-12 à 21:34, la quantité de matière pour le 4x4, par exemple, correspond à 0,135 L qui le volume d'essence par km. Donc on obtient bien une quantité de matière par km.
je ne c'est pas édité mon sujet j'ai pas trouver alors je re-post
donc pour la 6 kérosène j'ai trouver 3746.36 et c'est quel unité ?
je ne c'est pas édité mon sujet
==> je ne sais pas éditer mon sujet
On ne peut pas modifier un message posté.
pour la 6 kérosène j'ai trouver 3746.36 et c'est quel unité ?
Je trouve 162,16 kg...
Donne les détails de ton calcul...
Et pour le 4x4, tu trouves combien ?
Masse de kérosène pour 1 km :
1000  0.8
0.8  14 = 11,2.103 g
14 = 11,2.103 g
==> exact
On a 11 fois plus de CO2 ==>
Ce qui nous donne :
Masse d'essence pour 1 km :
On a 8 fois plus de CO2
Masse de CO2 :
Pour l'aller-retour Paris-Marseille avec le 4x4 :
A raison de 308 g.km-1 de CO2, on a donc 308 1600 g de CO2 pour Paris-Marseille aller-retour avec un 4x4. Mais il y a 2 personnes à bord et on demande la masse de CO2 par personne donc
1600 g de CO2 pour Paris-Marseille aller-retour avec un 4x4. Mais il y a 2 personnes à bord et on demande la masse de CO2 par personne donc de CO2. Soit 2,464.105 g de CO2 ==> 246,4 kg de CO2.
Pour l'aller-retour Paris-Marseille avec l'avion et 300 passagers :
de CO2.
Donc l'avion minimise l'émission de CO2.
Tu refais et vérifies tout, bien entendu...


