Inscription / Connexion Nouveau Sujet
Les composés oxygénés
S'il vous plaît aidez moi !
On vaporise 2445 mg d'un composé A de formule brute CxHyOz. La vapeur obtenue occupe un volume de 740m3.
1) déterminer la masse molaire moléculaire du composé A.
2)Le composé A contient en masse 64,87 % de carbone et sa molécule comporte quatre fois plus d'atomes de carbone que d'atomes d'oxygène.
Détermine la formule brute exact de A.
Je vous en remercie d'avance.
Bonjour,
Il faut tout d'abord corriger ton énoncé et tout particulièrement la phrase :
" On vaporise 2445 mg d'un composé A de formule brute CxHyOz. La vapeur obtenue occupe un volume de 740m3. "
Ces données conduisent à une impossibilité. Il est probable que les unités utilisées ici soient fausses.
De plus le volume molaire des gaz dans les conditions de l'expérience doit être connu.
S'il n'est pas donné dans l'énoncé il faudra utiliser une valeur approximative (que tu devras te procurer par tes propres moyens) et la précision du résultat en souffrira.
On vaporise 2445 mg d'un composé organique A de formule brute CxHyOz. La vapeur obtenue occupe un volume de 740 cm3 .
1) Déterminer la masse molaire moléculaire du composé A.
2) Le composé A contient en masse 64,87% de carbone et sa molécule comporte quatre fois plus d'atomes de carbone que d'atomes d'oxygène.
Détermine sa formule la formule brute exacte de A.
3) On suppose que la formule brute de A est C4H10O .
3-1) Donner les fonctions chimiques possibles de A et les groupes fonctionnels correspondants.
3-2)Donner les formules semi-développées et noms des composés possibles.
3-3) Le composé A contient une chaine carbonnée ramifiée portant un groupe hydroxyle fixé en bout de chaine.
Donner la formule semi-développée exacte et le nom de A.
Volume molaire : Vo=22,4 L /mol.
Question 1 :
Le volume de vapeur de A associé au volume molaire des gaz permettent de calculer la quantité de matière de A ( en mol)
et
La quantité de matière de A associée à la masse de A permettent de répondre à cette question.
J'ai trouvé : Ma=74 g/mol
En faisant le rapport du volume de vapeur obtenue sur le volume molaire égal au rapport de la masse de A sur la masse molaire de A.
C'est très bien !
Question 2 :
En utilisant la masse molaire de A (donc 74g/mol) , la masse molaire du carbone (12g/mol), la formule CxHyOz de A et le pourcentage de carbone dans A ( 64,87% ou 0,6487 ) on obtient la valeur de "x"
Une fois la valeur de "x" connue on en déduit celles de "z" et de "y" et on obtient ainsi la formule brute de A
Je ne sais pas trop comment tu es arrivé à ce résultat mais il est exact.
Tu peux accéder maintenant facilement à la formule brute de A
Je suis en difficulté !
Le fait qu'il a été dis dans l'exercice "sa molécule comporte quatre fois plus d'atomes de carbone que d'atomes d'oxygène "
Doit être pris en compte non ?
Ce n'est pas pour rien que le detail à été donné !
Bien raisonné !
La molécule comporte 4 fois plus d'atomes de carbone que d'oxygène est en effet un renseignement très utile.
Surtout que tu as déjà trouvé que x=4 donc que cette molécule CxHyOz contient 4 atomes de carbone !
Le y ne pas être égale à 1 , car nous sommes dans les composés oxygénés et qu'il y'a 2 possibilités de l'obtenir .
Soit y=2n+2 soit y=2n
N'est-ce pas ?
OK
La molécule A a donc pour formule C4HyO et sa masse molaire est de 74g/mol
Trouver la valeur de y est maintenant un jeu d'enfant non ?
La formule brute de A est C4H10O
On pouvait s'en douter, compte tenu de la manière dont est introduite la question 3
Oui, c'est exact.
Question 3.2)
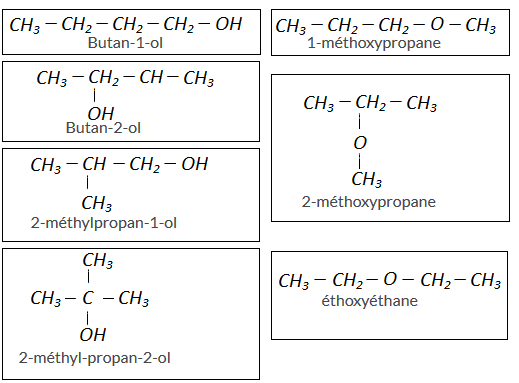
J'ai trouvé 7 molécules de formule brute C4H10O
4 d'entre elles sont des alcools et 3 des éthers-oxydes.
Je te laisse proposer les formules semi-développées et les noms de ces molécules.
Question 3.3)
Une seule des 7 molécules précédentes contient une chaine carbonée ramifiée portant un groupe hydroxyle fixé en bout de chaine.
Cela permet de l'identifier facilement.
Comment je peux récrire mes formules développées ?
Et si, je proposais seulement les noms ?
Mon clavier ne dispose pas de barre pour les ramifications .
J'ai trouvé également 4 alcools que sont:
Le butanol , butan-2-ol , 2-methylpropan-2-ol et le 2-methylpropanol.
Au niveau des éther oxydes :
Methoxypropane et le mettent 1- methyléthane .
C'est exact ?
Pour les alcools :
Butan-1-ol : CH3-CH2-CH2-CH2OH
Butan-2-ol : CH3-CH2-CHOH-CH3
2-méthylpropan-1-ol : CH3-CH(CH3)-CH2OH
2-méthyl-propan-2-ol : CH3-C(CH3)2-OH
Pour les éther-oxydes:
1-méthoxypropane : CH3-CH2-CH2-O-CH3
2-méthoxypropane :CH3-CH(O-CH3)-CH3
éthoxyéthane : CH3-CH2-O-CH2-CH3
Les termes entre parenthèse représentent les chaînes dérivées.
Bonjour, je vois maintenant.
Je vous remercie de m'avoir accorder "un peu" de votre temps .
Bonne journée à vous !