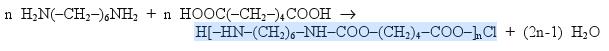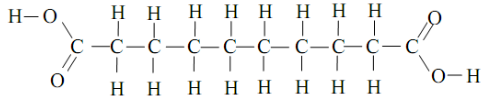Inscription / Connexion Nouveau Sujet
Le nylon
Le nylon 6-10 a pour formule semi-développée :
1. Que signifie le terme " 6-10 "
2. Ecrirer les formules semi-développes des reactifs
3. En deduire l'équation de reaction permettant de fabriquer le nylon
4. Determiner le nombre moyen de motifs d'un fil de couture de 2 g
M(H) = 1 ; M(C)= 12 ; M(O)=16 et M(N)=14
Bonjour Pourriez vous m'aider svp
J'estime avoir été poli.. Bonjour svp ..
1) le terme 6-10 signifie que le nylon 6-10 est forme d'une diamine de 6 carbone et d'un dichlorure d'acide de 10 carbonne
2)Je ne sais pas
3)
4) je ne comprend pas
Ca se met au début du message, pas noyé dans le flot de l'énoncé.
Généralement quelqu'un qui veut t'aider et voit que ça commence de manière abrupte par l'énoncé ne cherche pas à aller plus bas. Ne le prend pas mal c'est juste un conseil pour les prochaines fois, si tu veux trouver de l'aide.
1) tb
2) tu dois juste enchaîner 8 fois le motif CH2
3) il faut équilibrer en remplaçant les n
4) il te faut l'équation pour faire les calculs
2) oui, pour le nylon si tu écris de manière compacte, sinon oublie avant de devoir changer de page 
3) non il faut que ce soit un coefficient
D'accord merci pour la question 3 meme si cela me semnble imconprehensible.. comment j'aplique cette esaution pour la question 4 ?
Là tu as fait la formule développée, on te demande la semi-développée. Laisse COOH et les 8 groupements CH2
Tu calcules la masse avec les masses molaires (tu veux la masse d'un motif)
donc COOH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH ??
Oui mais je n'ai pas la masse molaire moleculaire ( ex : MH4CN5)donc comment je fait pour calculer ?.
oui c'est bien ça.
Tu cherches à la calculer justement : la masse molaire moléculaire d'un motif. Ce que tu veux en gros c'est trouver n ---> n est le nombre de motifs présents dans 2 g de fil
Ok?
Tu calcules M pour le nylon (ce que tu as entre crochet). Or tu es d'accord que ce motif est répété plusieurs fois dans un fil de nylon. Ce nombre de fois c'est n (notation maladroite que l'on pourrait confondre avec la quantité de matière).
oui, n'hésite pas à factoriser par n. Je dois faire quelques courses, ne t'inquiète pas je reviens par la suite 
MC16O2H30N2 ?
MC16O2H30N2 = Mc x 16 + MO x 2 + MH x 30 + MN x 2 = 12 x 16 + 16 x 2 + 1 x 30 + 14 x 2 = 192 + 32 + 30 + 28 = 282 g.mol-1
Par contre factoriser par n.. je sais pas comment faire
Tu as simplement n fois cette masse molaire dans le fil 
Si on simplifie à l'extrême pour ta réaction ça donne ça :
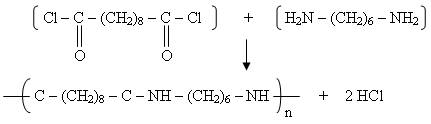
Ensuite il y a un souci d'unité, il doit manquer une donnée à ton exercice car il faudrait pouvoir convertir cette masse molaire en masse...
bonjour
pourriez vous m'aider pour la question 4
j'ai calculée la masse molaire qui est de 282g.mol-1
je voudrai savoir comment calculer la masse d'un motif et le nombre de motif ??