Inscription / Connexion Nouveau Sujet
le complexe "bleu céleste" : chimie
Voila il ne s'agit pourtant pas d'un exercice difficile a priori mais je bloque lors d'une question, voila en détail :
En présence de molécules d'ammoniac NH3, en quantité suffisante, les ions cuivre (II) CU²+ donnent un complexe d'un trés beau bleu Cu(NH3)4²+ selon l'équation :
Cu²+ +4Nh3 = Cu(NH3)4²+ avec K = 2.0x10^12.
Dans un bécher, on place 90 mL d'une solution aqueuse A de sulfate de cuivre (II), de concentration en ion Cu (II) : [Cu²+] = 1.0x10^-3 mol/L, auxquels on ajoute 10 mL d'une solution aqueuse B d'ammoniac Nh3, de concentration [Nh3] = 5.0 mol/L.
Voila pour l'énoncé, passons aux questions  :
:
1.a) Calculer le quotient de réaction a l'état initial Qri
Ma réponse : Qri=0 car [Cu(NH3)4²+] = 0 a t=0
1.b) En déduire le sens d'évolution spontannée du systeme a partir de l'état initial.
Ma réponse : On a Qri=0 et K = 2.0x10^12, donc Qri<< K, le systeme evolue donc spontanément dans le sens direct, de plus K>>10^4 donc la réaction est total.
2.a) Construire le tableau descriptif de l'évolution du systeme en utilisant l'avancement volumique y.
Voila mon tableau, la réaction etant total j'ai mis [Cu²+] = 0 mol/L :
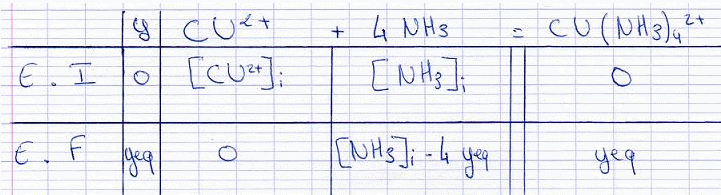
2.b) Donner la relation entre l'avancement volumique a l'équilibre yeq et K. Calculer yeq. Pour cela, on négligera yeq devant la concentration initial en ammoniac dans le mélang, [NH3], et on écrira: [NH3i] - 4yeq = [NH3]i.
Voila il s'agit de la question ou je coince car bon je pose Yeq = [Cu(NH3)4²+]eq ou [Cu²+]i
et K = [Cu(NH3)4²+]eq / ([Cu²+]eq x [NH3]^4)
La relation pourrait donc être K = Yeq/([Cu²+]eq x [NH3]^4).
Mais voila je ne sais pas si cette relation (bien que je pense correct) est la bonne car lorsqu'il faut ensuite calculer Yeq, j'ai un probleme car j'ai admis que [Cu²+]eq = 0 (voir tableau). Donc voila je ne sais pas comment faire  .
.
3) Comparer Yeq a l'avancement volumique maximal. Conclure: existe t il des ions Cu(II) "libres" en présence du complexant NH3?
Bon la meme sans avoir la réponse a la question précédente, je pense que yeq<ymax, il restera donc des ions Cu(II) "libres" qui n'ont pas réagit.
4)Justifier alors l'utilisation de ce complexe pour la détection des traces d'ions Cu(II) en solution aqueuse.
L'utilisation de ce complexe permet ainsi de detecter des traces d'ions Cu(II), en effet plus le complexe est d'un bleu "profond", plus la quantité de matiere de Cu(II) est faible. Cec omplexe permet donc la détection des traces d'ions Cu(II) en solution aqueuse.
Voila merci d'avance a ceux qui voudront bien m'aider et bonne chance en esperant que vous n'en ayez pas besoin 
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]() [lien]
[lien]
salut:
1) a)Qri=0
b) K = 2.0x1012, donc Qri<< K, le systeme evolue donc spontanément dans le sens qui fait augmenter le quotiet de la réaction donc ds le sens direct, de plus K>>104 donc la réaction est total. correct.
a)
le tableau descriptif de l'évolution .
on a:
n(Cu)o2+=[Cu2+]V=10-3 mol/L90.10-3 L .=9.10-5 mol.
et:
n(NH3)[sub]=[nh3]V=5-3 mol/L10.10-3 L .=5.10-2 mol.
par conséquence le tableau sera comme ceci:
Cu²+ + 4NH3 = Cu(NH3)42+
9.10-5 5.10-2 0
9.10-5-y 5.10-2 -4y y
Merci pour cette premiere aide, néanmoins je n'arrive toujours pas a exprimer Yeq en fonction de K. Si tu peux me donner une piste ou si quelqu'un d'autre pourrait m'aider ce serait sympa merci 
.
est ce que ça ((on négligera yeq devant la concentration initial en ammoniac dans le mélange)) c'est une donnée que tu as ds l'énoncé?
attention:
ds la relation de k =>[Cu2+]=9.10-5-y
erreur de tappe.
or on négligera yeq devant la concentration initial en ammoniac dans le mélange
Donc: [NH3i] - 4yeq = [NH3]i=5.10-2 mol/L
Par conséquence:
=> y=2.1012.5.10-2(9.10-5-y)
càd 1011(9.10-5-y)=y
9.106-1011y=y
9.106=y(1011+1)
3)or les ions Cu2+ sont utilisés en défaut => Cu2+ est le réactif limittant.
donc:
avancement max correspond à :
9.10-5-ymax=0
yeq =ymax.
Conclusion: Les ions Cu(II) "libres" n'exitent pas en présence du complexant NH3.
Merci beaucoup pour cette aide précieuse, néanmoins, il me semble que tu as fais une erreur, pas dans la démonstration mathématique mais avant car on a une solution A de concentration en ion Cu (II) : [Cu²+] = 1.0x10^-3 avec V=90mL.
Ensuite on rajoute V'=10 mL d'une solution B d'ammoniac. Donc le volume total vaut V''=100 mL .
-Soit dans le becher la concentration en ion Cu (II) vaut 1.0x10^-3 x (V/V'') = 9x10^-4 non ? .
-De plus comment tu trouves cette valeur : 5.10^-2 c'est celle de [NH3]^4 ? Pourtant par le meme raisonnement je devrais trouver (5x(V'/V''))^4 = 6.25x10^-2.
Mais le plus étonnant, c'est que si je suis ton raisonnement avec mes propres données, et bien je retrouve ma concentration en ion Cu (II) : 9x10^-4. Donc ta démonstration est bien correct  , je trouve bien yeq = ymax .
, je trouve bien yeq = ymax .
Donc comme tu la dis les ions Cu(II) "libres" n'exitent pas en présence du complexant NH3.
Ce complexe permet donc la détection d'ion Cu (II) puisque la réaction etant total, si des ions cuivre (II) sont présent, la solution prend une couleur bleu trés caractéristique. ==> Cette derniere analyse est elle correct ?
Voila merci encore de m'aider j'arrive au bout 

on avait consédéré V=1L
le volume totale du mélange étant:
V = V1+V2=10+90=100mL=0,1L
Cu 2+ + 4NH3 = Cu(NH3)42+
9.10-5 5.10-2 0
9.10-5-yeq 5.10-2 -4yeq yeq
SI on néglige yeq devant la concentration initial en ammoniac dans le mélange le tableau devient:
Cu 2+ + 4NH3 = Cu(NH3)42+
9.10-5 5.10-2 0
9.10-5-yeq 5.10-2 yeq
=>
d'ou:
avec k= 2.1012 V=10-1 L


