Inscription / Connexion Nouveau Sujet
La survie de l'artémia
Bonjour, j'aimerais connaitre la méthode pour pouvoir résoudre un exercice de ce type. Merci d'avance.
Document 1 : L'artémia
L'artémia est un petit crustacé qui ne se développe que dans les milieux marins dont la concentration massique moyenne en ions chlorure Cl- est supérieure à 30 g.L-1. Dans ces conditions, son développement n'est pas compromis car les prédateurs aquatiques ne supportent pas des conditions salines aussi élevées.
Document 2 : Etude conductimétrique
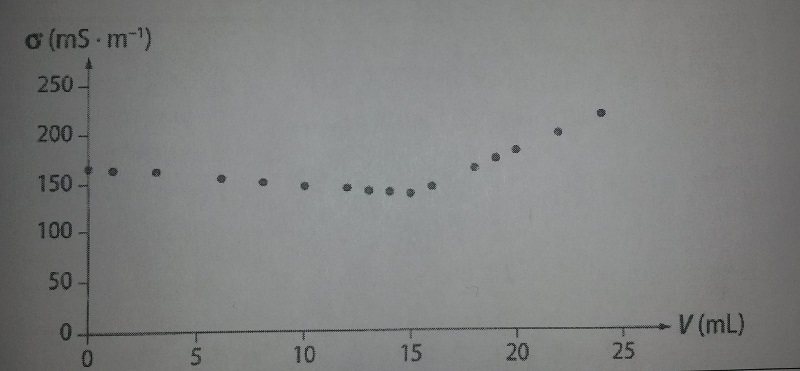
On a prélevé un échantillon d'eau dans un marais salant prévu pour implanter un élevage d'artémias. Cette eau contient exclusivement des ions sodium et chlorure. On dilue 10 fois l'eau prélevée et on réalise ensuite le dosage par conductimétrie de 10,0 mL de cette eau diluée par une solution de nitrate d'argent de concentration C2 = 1,00.10-1 mol.L-1. L'évolution de la conductivité  au cours du dosage en fonction du volume de solution de nitrate d'argent est représentée ci-dessous. (voir photo ci-jointe)
au cours du dosage en fonction du volume de solution de nitrate d'argent est représentée ci-dessous. (voir photo ci-jointe)
Document 3 : Données
Conductivités molaires ioniques à 25°C :
 (Cl-) = 7,63.10-3 S.m².mol-1 ;
(Cl-) = 7,63.10-3 S.m².mol-1 ;  (NO3-) = 7,14.10-3 S.m².mol-1.
(NO3-) = 7,14.10-3 S.m².mol-1.
Problème : L'eau du marais salant est-elle favorable au développement des artémias ?
bonjour,
il faut vérifier que la concentration massique de l'eau en en Cl- est supérieure à 30g/L.
Le dosage conductimétrique permet de trouver la concentration molaire de l'échantillon dilué .
On calcule ensuite la concentration en Cl- de l'eau du marais ,sachant que l'échantillon dosé est 10 fois moins concentré en Cl-
finalement on calcule la concentration massique de l'eau du marais
Le dosage conductimétrique permet de trouver la concentration molaire de l'échantillon dilué .
Je crois que j'ai compris le reste mais ça j'ai pas compris :/ pourriez vous m'expliquer comment faire ?
Est ce que c'est 10 mL correspond à 150 mS.m-1
bonjour
le volume de AgNO3 versé à l'équivalence est voisin de 15 mL (V(Ag+)eq ).Faire le tracé nécessaire
(revois ,si nécessaire le principe d'un dosage conductimétrique via Google)
A l'équivalence la quantité de matière de Cl- contenue dans 10 mL de solution diluée est égale à la qté de matière de Ag+ versée
soit [Cl-]*V(Cl-) = [Ag+]*V(Ag+)eq
on en déduit [Cl- ]de la solution diluée
L'eau prélevée a été diluée 10 fois.
On calcule donc la concentration en Cl- de l'eau prélevée.puis la concentration massique en Cl-
On compare le résultat avec le minimum nécessaire en Cl- pour que les artemias puissent se développer.
A l'équivalence :
Concentration en Ag+ = concentration en Cl- donc [Cl-]*V(Cl-) = [Ag+]*V(Ag+)
[Cl-] = [Ag+]*V(Ag+)éq / V(Cl-) = 15.10^(-3) mol/L
v(Ag+)= 15 mL V(Cl-)=10 mL
[Cl-]= 1,0.10-1 * 15.10-3/10.10-3=1,5.10-1 mol/L
remarque n peut garder les volumes en mL puisqu'on a un volume au numérateur et au dénominateur
n peut garder les volumes en mL puisqu'on a un volume au numérateur et au dénominateur
[Cl-]= 0,10*15/10=0,15 mol/L
Merci !
Ensuite je dois convertir en g/L et comparer avec la valeur de l'énoncé?
Ou bien convertir la valeur de l'énoncé à mol/L et comparer avec la valeur trouvée?
C'est ce que j'ai fait et j'ai trouvé une valeur inférieure à 30 g/l donc l'eau n'est paq favorable
Est ce correct ?
je trouve au contraire une valeur supérieure à 30g/L
la concentration de l'eau en CL- est 10fois plus importante que celle dosée.(on a dilué 10 fois)
la concentration de l'eau du marais en CL- vaut donc 1,5 mol/L
m(Cl-)= C*35,5 =53 g/L
D'après le document 2, le volume d'ions argent à l'équivalence est de 15 mL. On peut donc écrire V(Ag+)éq = 15 mL.
Calculons la concentration en ion chlorure est 1,5.10^(-1) mol/L.
Il faut maintenant multiplier cette concentration par 10 puisqu'on nous précise dans le document 2 que la solution a été diluée 10 fois. La concentration de l'eau du marais en ions chlorure vaut donc 1,5 mol/L.
Il faut alors convertir la concentration massique moyenne indiquée dans le document 1 en mol/L.
c = t/M(Cl-) = 30/35,5 = 8,45.10^(-1) mol/L.
1,5 > 8,45.10^(-1) donc l'eau du marais est favorable



