Inscription / Connexion Nouveau Sujet
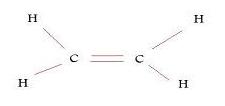
La molécule d'éthylène
Bonjour,
Matière / Niveau: Chimie
Problème ou exercice: Exercice
Où j'en suis: Au début
Mes questions: Je sais pas comment m'y prendre vu qu'on a pas fait de lecon j'ai essayé de comprendre dans le livre en vain.
Le schéma représente la répartition spatiale des atomes de la molécule d'éthylène de formule H2C = CH2
L'atome de carbone est plus électronégatif que l'atome d'hydrogène.
1. Expliquer pourquoi la liaison unissant les deux atomes de carbone n'est pas polarisée
2. Représenter les déplacements électroniques des liaison C--H unissant les atomes de carbone aux atomes d'hydrogène
3. Expliquer pourquoi la molécule d'éthylène n'est pas polaire
Merci pour l'explication
Salut !
!
Pas mal comme en-tête, au moins avec toi c'est clair
1) Qu'est-ce-qui fait qu'une liaison est polarisée? Ces deux atomes sont identiques
2) Tu dois représenter les "deltas"...
3) Ca rejoint un peu la question 1... Tu vois que la configuration de la molécule est un peu spéciale non?
Merci pour l'en tête
Pour la c j'ai mis que la liaison de la molécule est polarisée mais la symétrie de cette molécule fait qu'elle n'est pas polaire 



