Inscription / Connexion Nouveau Sujet
La masse molaire du linalol
Bonsoir, j'aimerai savoir si mes réponses sur juste pour cette exercice s'il vous plaît.
Pour obtenir de l'huile essentielle de lavande, on utilise une technique appelée hydrodistillation.
L'huile essentielle de lavande contient plusieurs constituants, dont le linalol de formule C10H18O.
Dans une expérience, on obtient 50,0 mL d'huile essentielle composée en partie de linalol. Le volume de linalol obtenu a une masse de 0,435g.
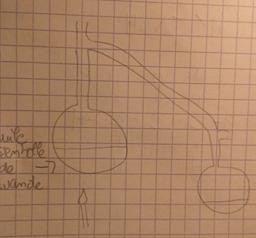
1) Faire un schéma simplifié de l'expérience.
(Voir photo)
2) Calculer la masse molaire du linalol.
10*12 + 1*18 + 1*16
= 120+18+16
= 154g/mol
3) Calculer alors la quantité de matière ( ou nombre de moles) de linalol obtenu au cours de l'expérience.
154 * x = 0,435
x = 0,435/154 = 0,028 mol
4) Calculer la concentration molaire (en mol/L) de linalol dans les 50,0 mL d'essence de lavande.
0,028*20 = 0,56mol/L
5) Donner ce résultat en g/L (on parle alors de concentration massique).
154*0,56 = 86,24 g/L.
Cordialement,
Merci d'avance
Héloïse
Merci pour l'aide au schéma. Mes réponses sont-elles justes maintenant?
3) Calculer alors la quantité de matière ( ou nombre de moles) de linalol obtenu au cours de l'expérience.
154 * x = 0,435
x = 0,435/154 = 0,0028 mol
4) Calculer la concentration molaire (en mol/L) de linalol dans les 50,0 mL d'essence de lavande.
0,435*20 = 8,7mol/L
5) Donner ce résultat en g/L (on parle alors de concentration massique).
154*8,7 = 1339,8 g/L.
Merci pour l'aide au schéma. Mes réponses sont-elles justes maintenant?
3) Calculer alors la quantité de matière ( ou nombre de moles) de linalol obtenu au cours de l'expérience.
154 * x = 0,435
x = 0,435/154 = 0,0028 mol
Exact, mais je préfère n=2,82.10-3 mol
4) Calculer la concentration molaire (en mol/L) de linalol dans les 50,0 mL d'essence de lavande.
0,435*20 = 8,7mol/L
Non
La concentration molaire est le rapport entre la quantité de matière (en mol) et le volume ( en litres )
C = n/V = 2,82.10-3 / 50.10-3 = 5,64.10-2 mol/L
5) Donner ce résultat en g/L (on parle alors de concentration massique).
154*8,7 = 1339,8 g/L.
A revoir.
Il suffit de passer dans le résultat de la question précédente des moles aux grammes.
Merci encore de prendre le temps de me répondre!
J'ai mieux compris la question 4.
Du coup d'après la formule, pour la question 5:
Cm= C*M
Cm= 5,64.10-² * 154
Cm = 8,68 g/L
J'espère avoir compris...