Inscription / Connexion Nouveau Sujet
La durée de vie d'une pile
Bonjour
j'aurai besoin d'aide pour cet exercice. Voici les questions :
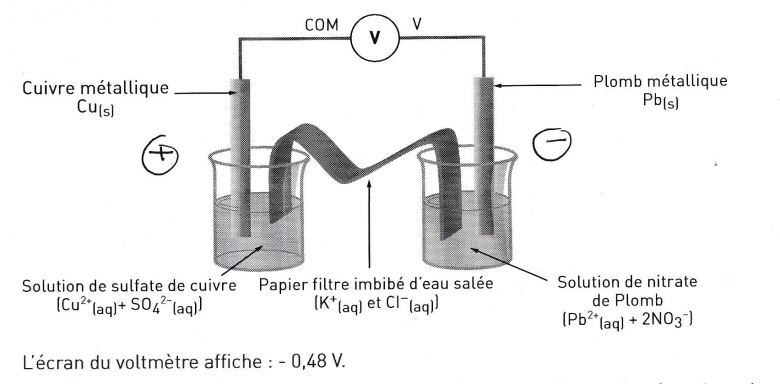
1) d'après le document ci dessus et la mesure de voltmètre, donnez les équation des réactions qui se déroulent dans les deux compartiments lorsque la pile fonctionne.
(Détaillez les étapes de votre raisonnement)
Les compartiments sont constitués de la manière suivante :
Volume initial des solutions : V = 50.0mL
Concentration initiales des solutions : C=0.50mol.L-1
Masse de l'électrode de cuivre qui plonge dans la solution : m(Cu) = 4.2g
Masse de l'électrode de plomb qui plonge dans la solution : m(Pb) = 9.7g
2) calculez l'avancement maximal de la réaction qui se déroule dans la pile lorsqu'elle débite du courant.
3) Quelles modifications proposez vous pour que la pile fonctionne deux fois plus longtemps dans même conditions d'utilisation ?
Mon avancée :
1) Le voltmètre mesure une tension négative. On en conclut que la borne V est reliée au pôle - de la pile (l'anode). On sait également qu'il se dérouile une oxydation à l'anode et réduction à la cathode. on peut donc à l'aide du schéma définir les demi-équations rédox de chaque pôle
Pb(s) = Pb2+ (aq) + 2e-
Cu2+ (aq) +2e- = Cu(s)
On en conclut l'équation d'oxydo-réduction :
Pb(s) + Cu 2+ (aq) -> Pb2+(aq) + Cu(s)
Est ce bon ?
2) faut il faire un tableau d'avancement ? Si oui je voudrai d'abord que vous confirmiez mon équation d'oxydo-reduction car j'ai un doute
3) Augmentez la quantités des réactifs
Merci de ta réponse, j'ai juste une question, comment je dois utiliser les données :
Volume initial des solutions : V = 50.0mL
Concentration initiales des solutions : C=0.50mol.L-1
Masse de l'électrode de cuivre qui plonge dans la solution : m(Cu) = 4.2g
Masse de l'électrode de plomb qui plonge dans la solution : m(Pb) = 9.7g
il faut que je calcule n= C x V ?
comment je dois utiliser les données
C'est à cela que vont servir les données quantitatives de l'énoncé.
Bonsoir, pour le tableau d'avancement c'est réglé, je l'ai fait, j'en ai déduis que le réactif limitant est cuivre (II)
Pouvez vous m'aidez pour la question 3, est ce que la réponse que j'avais proposé est valable ?
3) Augmentez la quantités des réactifs
Doubler les quantités
Volume initial des solutions : V = 0.1 L
Concentration initiales des solutions : C= 1 mol.L-1
Masse de l'électrode de cuivre qui plonge dans la solution : m(Cu) = 8.4g
Masse de l'électrode de plomb qui plonge dans la solution : m(Pb) = 19.4g
Doubler les quantités
Volume initial des solutions : V = 0.1 L
Concentration initiales des solutions : C= 1 mol.L-1
Masse de l'électrode de cuivre qui plonge dans la solution : m(Cu) = 8.4g
Masse de l'électrode de plomb qui plonge dans la solution : m(Pb) = 19.4g
-seules les quantités initiales des réactifs sont à modifier.
-il n'est pas nécessaire qu'il reste du plomb en fin de réaction, il suffit donc de prévoir des quantités stoechiométriques d'ion Cu2+ et de plomb métal Pb
Je vous proposerai plutôt quelque chose comme :
n(Cu2+) = 2 C1 V1 ( C1 et V1 désignant les données de la 1° question)
n(Pb) = n(Cu2+) soit numériquement n(Pb) = 2
 50 10-3
50 10-3  0.50 = 50 10-3 mol et m(Pb) = 50 10-3
0.50 = 50 10-3 mol et m(Pb) = 50 10-3  207.2
207.2  10.4 g
10.4 g
OK ?
Remarque : le calcul de la masse minimale de plomb est purement théorique, car si la dégradation de l'électrode de plomb se fait plus vite au voisinage de la surface de la solution dans laquelle elle plonge, une partie de cette électrode risque de se briser et de tomber au fond du bécher de droite provocant ainsi, de manière anticipée, la fin de la réaction...
@elisa59185
Bonjour.
comment vous avez fait le tableau d'avancement? je n'y arrive pas du tout?
| Cu2+ | + | Pb |  | Cu | + | Pb2+ | |
| x = 0 | n0(Cu2+) = C V | n0(Pb) = m(Pb) / M(Pb) | n0(Cu) = m(Cu) / M(Cu) | n0(Pb2+) = C V | |||
| x > 0 | n(Cu2+) = C V - x | n(Pb) = m(Pb) / M(Pb) - x | n(Cu) = m(Cu) / M(Cu) + x | n(Pb2+) = C V + x | |||
| xmax | n(Cu2+) = C V - xmax = 0 | ou | n(Pb) = m(Pb) / M(Pb) - xmax = 0 | n(Cu) = m(Cu) / M(Cu) + xmax | n(Pb2+) = C V + xmax |
Au revoir.



