Inscription / Connexion Nouveau Sujet
La décomposition de l'eau oxygéné
Bonjour .
On étudie la décomposition au cour s du temps en présence d'un catalyseur , d'une solution aqueuse d'eau oxygénée H2O2? de concentration molaire c0=9 10-2mol.L-1 à t=0s , suivant la réaction : 2H2O2 (aq)
10-2mol.L-1 à t=0s , suivant la réaction : 2H2O2 (aq)  O2 + 2H2O (l) .
O2 + 2H2O (l) .
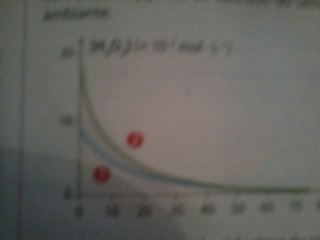
La courbe 1 donne l'évolution de la concentration de la solution d'eau oxygénée en fonction du temps , à température ambiante .
1. L'eau oxygénée est le réducteur du couple O2 (g) / H2O2 (aq).
En utilisant l'équation de l'énoncé donner le second couple auquel appartient l'eau oxygénée .
2. En exploitant la courbe 1, justifier le fait que l'on peut considérer la décomposition de l'eau oxygénée comme une réaction lente et totale.
3. La courbe 2. donne l'évolution de la concentration de la solution d'eau oxygénée en fonction du temps , avec une concentration initiale c'0=1,8 10-1 mol.L-1 .
10-1 mol.L-1 .
A partir des deux courbes , déterminer l'influence de la concentration initiale sur le temps de demi-réaction .
4. tracer sur la figure l'allure de la courbe donnant, pour une température plus faible , l'évolution temporelle de la concentration de la solution d'eau oxygénée , avec une concentration initiale c"0=c0=0 10-2 mol.L-1 .
10-2 mol.L-1 .
1. H2O2/H2O .
2.c'est une réaction lente elle se fait en 75 min .Elle est totale car à la fon de la réaction il ne reste plus de H2O2 .
3.la je ne sais pas trop . les 2 courbe on l'air de s'arrêté à la même minute donc il est atteint en même temps .
mais les quantité ne sont pas les même . la courbe verte atteint la moitié de sa quantité initiale au bout de environ 6-7 min . et la courbe bleu atteint la moitié de sa quantité initiale au bout de environ 14 min .
la la problème c'est que je ne sais pas comment calcule t1/2 . est-ce que c'est le t fininal divisé par 2 ou est-ce que on regarde quand il arrive à la moitié de sa quantité initiale .
4. comme la température est plus faible , la courbe sera moins courbé que la courbe bleu .
la courbe verte représente la solution qui a une plus grosse concentration molaire . ellene devrait pas atteindre l'avance final en premier ? ( parce que sur le dessin c'est en même temps )
merci d'avance .
salut  !
!
1) TB
2) ok
3) tu as les bons éléments c'est bien.
t1/2 c'est ça
est-ce que on regarde quand il arrive à la moitié de sa quantité initiale
4) oui TB
la courbe verte représente la solution qui a une plus grosse concentration molaire . ellene devrait pas atteindre l'avance final en premier ? ( parce que sur le dessin c'est en même temps )
3. donc si la concentration augmente alors le temps de demi-réaction est atteint plus vite .
normalement elle l'atteint en premier . ( j'ai dis le contraire dans mon premier post . )
si le temp demi réaction est atteint en premier est-ce que la réaction se finie plus vite ?
parce que avec un catalyseur sa augment la vitesse d'une réaction . donc quand on introduit un catalyseur le temps de demi-réaction est atteint plus vite et la réaction se fini plus vite aussi .
Oui je suis tout à fait d'accord là-dessus. Sur le concept. Ceci dit plus tu as de molécules plus la probabilité qu'elles se rencontrent dans le mélange est forte, donc plus les réarrangements sont nombreux ---> réaction plus rapide.
Si tu en as moins c'est l'effet inverse.
Ça s'applique aussi bien au début qu'à la fin de la réaction. C'est pour ça que la réaction se termine en même temps. Sachant que la fin est asymptotique donc tu ne vois pas bien les nuances 
bonjour shadowmiko et hiphige.
Dans le cas de la dismutation de H2O2 ,le temps de 1/2 réaction est indépendant de la concentration,ce que semble vérifier les courbes (assez floues)
donc dans le cas de la verte à la fin on aura plus de produits .
coriolan .
comment ça ? c'est-à-dire que l'on peut avoir nimporte qu'elle concentration au départ , le temps de 1/2 réaction sera toujour pareille
mais ici quand on regarde la graphe les temps de demi réaction sont différent ?
mais ici quand on regarde la graphe les temps de demi réaction sont différent ?
Pourquoi ce point d'interrogation ?
Ton document est flou.Je ne peux pas vérifier si le temps de 1/2 réaction est vraiment le même pour des concentrations différentes.Par contre,avec un document net,tu dois pouvoir vérifier si graphiquement les temps sont très différents ou identiques (éventuellement très voisins).
Ma réponse est étayée sur une recherche sur internet.
J'ai trouvé que la dismutation de H2O2 (c'est le nom de la réaction de décomposition) obéissait à une loi de vitesse dite du premier ordre.(La notion d'ordre n'est pas au programme de terminale générale).
Dans le cas d'une cinétique d'ordre 1 (premier ordre) le temps de 1/2 réaction est indépendant de la concentration.Normalement tu devrais pouvoir vérifier cela graphiquement.
Si ce n'est pas le cas,cela voudrait dire que ce que j'ai lu est faux (j'ai pourtant trouvé cette information sur plusieurs site).
Il faut cependant se méfier de généraliser .Les lois vérifiées expérimentalement ne sont souvent valables que dans un domaine plus ou moins limité.Dans le cas des solutions aqueuses,il faut qu'elles ne soient ni trop concentrées ni trop diluées.
Cependant ,dans le cas de ton exercice ,on te demande une conclusion à partir de 2 expériences.Il ne faut donc pas compliquer inutilement les conclusions.


