Inscription / Connexion Nouveau Sujet
La conductimétrie
Bonjour, voici le dm que j'ai a faire.
Etude d'une solution par conductimétrie [chap.4]
L'objectif de ce problème est de déterminer, par conductimétrie, la concentration en ions fluorure, f^- (aq), et en ions baryum, Ba2+ (aq), d'une solution aqueuse satmée de fluorure de baryum.
A. Étalonnage de la cellule
La cellule de conductimétrie utilisée est constituée d'électrodes planes et parallèles entre elles. Les dimensions des électrodes ne sont pas connues et difficiles à mesurer. Le rapport de la surface immergée sur la distance qui sépare les électrodes, SI L, peut être déterminé à partir de la mesure de la conductance d'une solution de concentration et de conductivité connues.
On utilise une solution de chlorure de potassium, de concentration égale à 1,00. 10-2 mol. L -1, dont la conductivité, à25°C, est égale à 149,8 mS. m-1. La cellule, totalement immergée dans la solution, est reliée à un GBF qui délivre une tension alternative sinusoïdale égale à 1,00 V Elle est en équilibre thermique avec la solution, à 25°C. L'intensité du courant électrique qui traverse la portion de solution comprise entre les électrodes est mesurée à l'aide d'un ampèremètre qui indique: 1,60 mA
1. Faire le schéma du montage utilisé pour cette mesure.
2. Calculer la conductance de la portion de solution comprise entre les électrodes.
3. Déterminer la valeur du rapport S/L.
B. Conductivité en fonction de la concentration
Dans le but de réaliser une courbe d'étalonnage a(sigma) = f(c), on réalise une gamme de solutions de concentrations de soluté apporté c différentes, à partir d'une solution mère de fluorure de baryum de concentration de soluté apporté égale à 5,00. 10-3 mol. L -1. Le montage de la partie A est alors utilisé pour effectuer les mesures consignées dans le tableau suivant. La tension électrique imposée est à chaque fois égale à 1,00 V.
c (mol.L-l) 5,00 . 10-3 2,00. 10-3 1,00.10-3 8,00.10-4 4,00. 10-4
1 (mA) 1,27 0,509 0,255 0,204 0,102
1. Calculer les volumes de solution mère à prélever pour réaliser 100 mL des solutions filles dont les concentrations de soluté apporté sont indiquées dans le tableau. Indiquer la méthode de dilution.
2. Recopier le tableau et le compléter en calculant pour chaque solution:
- la conductance mesurée;
- la conductivité.
3. Tracer la courbe d'étalonnage a = f(c), avec a(sigma) en S. m-1 et c en mol. m-3.
Vérifier que son équation est de la forme a = K. c, où K est une constante dont on donnera la valeur et l'unité.
C. Solubilité du fluorure de baryum.
On réalise à présent une mesure avec le même dispositif pour une solution de fluorure de baryum saturée. On obtient une intensité égale à 1,63 mA pour une tension imposée égale à 1,00 V.
1. Calculer la conductance de la portion de solution saturée comprise entre les deux électrodes. .
2. Calculer la conductivité de cette solution.
3. En déduire la solubilité du fluorure de baryum en mol.L-I, puis en g.L-I.
D. Concentration en ions de la solution saturée
1. Écrire l'équation de dissolution dans l'eau du fluorure de baryum.
2. Calculer la concentration molaire en ions fluorure et en ions baryum de la solution saturée.
j'ai été absent a beaucoup de cours et je n'ai pas pu ratraper, si vous pouvez m'aidé merci.
Bonsoir,
On n'est pas sorti  !...
!...
A1
Je suppose que tu sais faire le schéma ?
A2
G = 1/R = I / U
A3
Tu dois connaître la formule G =  S/L ==> S/l = G /
S/L ==> S/l = G / 
Voilà pour le début et attention aux unités !
Oui, ça te permet de trouver quel est le volume de la solution mère qu'il faut prélever pour atteindre la concentration cherchée.
c (mol.L-l) 5,00.10-3 2,00.10-3 1,00.10-3 8,00.10-4 4,00.10-4
Si on affecte l'indice 1 à la solution mère et l'indice 2 à la solution à faire :
- pour la 1ère, c'est la même donc il faut prélever 100 mL
- pour la 2ème, C1 = 5,00.10-3 mol.L-l, V1 est ce que l'on cherche, C2 = 2,00.10-3 mol.L-l, V2 = 100 mL = 0,1 L
C1V1 = C2V2 ==> V1 = C2V2 / C1 ==> V1 = 2,00.10-3.10-1 / 5,00.10-3 = 4.10-2 L = 40 mL
On prélève donc 40 mL de la solution mère et on complète à 100 mL avec de l'eau distillée.
- pour les autres, il suffit d'appliquer la même chose, je te laisse faire...
Pour la B2
| c (mol.L-1) | 5,00.10-3 | 2,00.10-3 | 1,00.10-3 | 8,00.10-4 | 4,00.10-4 |
| I (mA) | 1,27 | 0,509 | 0,255 | 0,204 | 0,102 |
| G = I/U ( I en A, U en V ==> G en S ) U = 1,00 V | 1,27.10-3 | 0,509.10-3 | 0,255.10-3 | 0,204.10-3 | 0,102.10-3 |
 = G / (S/L) (S.m-1) S/L = 1,07.10-2 m = G / (S/L) (S.m-1) S/L = 1,07.10-2 m | 1,19.10-1 | 4,77.10-2 |
Je te laisse finir... Attention aux unités
Ne recopie pas "bêtement". Vérifie tous les calculs...
C1
G = I/U = 1,63.10-3 / 1,00 = 1,63.10-3 S
C2
 = G / (S/L)
= G / (S/L)
C3
En B3, on a  = K c ==> c =
= K c ==> c =  / K
/ K
K a été calculé en B3.
Bonjour , je suis étudiante en première S et je dois moi aussi faire le même DM j'ai réussi a avancer jusqu'à la question C3 mais il me semble que mon résultat pour K est faux , ce qui me bloque pour la suite de l'exercice. Si vous pourriez juste me donner un élément qui puisse me permettre de continuer... Merci d'avance!
Car ma courbe d'étalonnage ne passe pas par l'origine du repère donc la conductivité ne peut pas être égale a K.c ... et je ne trouve pas pourquoi elle ne passe pas par O ...
J'ai recopié le tableau que j'avais commencé en le complétant.
| c (mol.L-1) | 5,00.10-3 | 2,00.10-3 | 1,00.10-3 | 8,00.10-4 | 4,00.10-4 |
| I (mA) | 1,27 | 0,509 | 0,255 | 0,204 | 0,102 |
| G = I/U ( I en A, U en V ==> G en S ) U = 1,00 V | 1,27.10-3 | 0,509.10-3 | 0,255.10-3 | 0,204.10-3 | 0,102.10-3 |
 = G / (S/L) (S.m-1) S/L = 1,07.10-2 m = G / (S/L) (S.m-1) S/L = 1,07.10-2 m | 1,19.10-1 | 4,77.10-2 | 2,38.10-2 | 1,91.10-2 | 9,55.10-3 |
Il faut d'abord voir si tu es d'accord avec ça...
c
 K =
K =  / c
/ c
0 0
5,00E-03 1,19E-01 2,3800E+01
2,00E-03 4,77E-02 2,3850E+01
1,00E-03 2,38E-02 2,3800E+01
8,00E-04 1,91E-02 2,3875E+01
4,00E-04 9,55E-03 2,3875E+01
K moyen 2,3840E+01
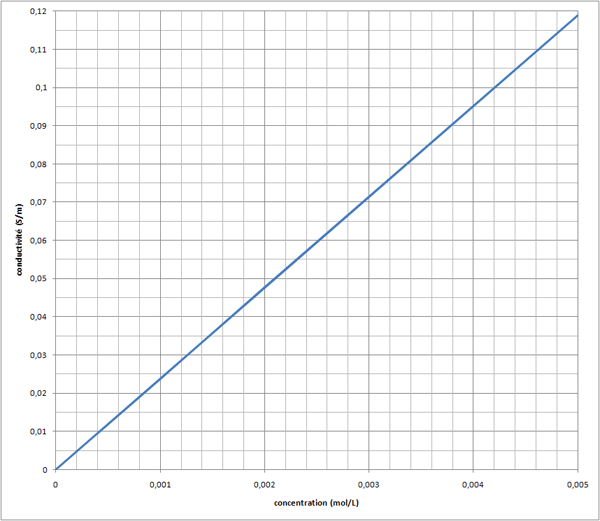
Merci beaucoup , j'ai trouvé ce qui n'allait pas , je suis parti sur K = c/ ! Normalement je devrai m'en sortir maintenant . Merci encore !
! Normalement je devrai m'en sortir maintenant . Merci encore !
Le probleme c'est que la concentration doit etre en mol.m-3 donc ma courbe ne fait pas une droite :s
Etes vous sur que K est egale a  /c Car quand je calcule le coef directeur de la droite avec la formule habituelle je trouve un K = 2,5
/c Car quand je calcule le coef directeur de la droite avec la formule habituelle je trouve un K = 2,5  10-2
10-2
Oui, je n'avais pas bien lu l'énoncé (ce n'est pas bien ! ) c est en mol/L. Il suffit de le transformer en mol/m3
) c est en mol/L. Il suffit de le transformer en mol/m3
5,00.10-3 mol/L = 5,00 mol.m-3
2,00.10-3 mol/L = 2,00 mol.m-3
1,00.10-3 mol/L = 1,00 mol.m-3
8,00.10-4 mol/L = 8,00.10-1 mol.m-3
4,00.10-4 mol/L = 4,00.10-1 mol.m-3
Et ce n'est pas ça qui empêche la courbe d'être une droite puisque c'est proportionnel (on multiplie les abscisses par 103).
Etes vous sur que K est egale a
 /c
/c Ce n'est pas moi qui le dis... C'est l'énoncé
3. Tracer la courbe d'étalonnage
 = f(c), avec
= f(c), avec  en S.m-1 et c en mol.m-3.
en S.m-1 et c en mol.m-3.
Vérifier que son équation est de la forme
 = K. c, où K est une constante dont on donnera la valeur et l'unité.
= K. c, où K est une constante dont on donnera la valeur et l'unité.je trouve un K = 2,5.10-2
Oui, c'est une bonne valeur quand c est en mol.m-3. Je trouve K = 2,384.10-2 S.m2.mol-1 (et K = 2,384.101 S.m-1.mol-1.L quand c est en L). Les deux valeurs sont voisines.
Merci je comprend mieux pourquoi la différence du K entre le votre et le mien !!!! Mon DM est fini , je vous remercie pour votre aide 
pourquoi la différence du K entre le votre et le mien
Des problèmes d'arrondis de calcul... Pour faire les calculs, je prends les valeurs exactes (==> trouvées) et je n'arrondis qu'à la fin (chiffres significatifs).
Sinon on a des arrondis d'arrondis d'arrondis et on ne sait plus trop ce qu'on a à la fin...


