Inscription / Connexion Nouveau Sujet
L'osmose inverse
Bonjour
Pouvez vous m'aider à résoudre cette difficulté ?
Calculez la pression osmotique en bar de l'eau de mer à 25°. L'eau de mer sera assimilée à une solution à 3% en masse de chlorure de sodium.
Données - masses molaires atomiques : M(Na)=23g.mol-1 ; M(CI)=35.5g.mol-1.
1 bar = 105PA.
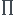 =icRT
=icRT
i : nombre d'espèces ioniques du soluté
c : concentration molaire de soluté (mol.m-3)
R : constante égale à 8.31J.mol-1.K-1
T : température (K)
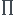 : pression osmotique (PA : pascal)
: pression osmotique (PA : pascal)
comment organiser mon raisonnement ? Par où commencer ?
Merci d'avance de votre aide 
bonjour,
il y a 2 espèces en solution (Cl- et Na+) donc i=2
pour calculer 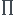 ,il faut connaître c.
,il faut connaître c.
La solution est à 3% en masse
On peut interpréter cette donnée de deux façons
soit 3 g de NaCl dans 100mL de solution
soit 3g de NaCl dans 100 g de solution
Il y a donc ambigüité.
Cependant,l'énoncé ne donne pas la densité de l'eau de mer.Dans ces conditions on ne peut pas calculer la masse de NaCl dans 1L d'eau de mer.
En conséquence ,je choisis d'interpréter 3% en masse comme 3g de NaCl dans 100mL soit 30 g/L.
Il suffit alors de calculer la concentration molaire de NaCl en mol/L et de convertir en mol/m3.
Enfin on applique la formule donnée pour calculer la pression osmotique.
On trouve environ 25,4 bar
puisqu'on donne la valeur approchée de 1,0kg/L pour la masse volumique de l'eau de mer ,la concentration massique est bien 30g/L.
Relation commode entre concentration massique et molaire:
Cm=C*M avec Cm concentration massique et C concentration molaire.
Donc C= Cm/M avec M=58,5g/mol
on trouve la concentration en mol/L
la concentration en mol/m3 est 1000 fois plus grande.
appliquer ensuite la formule donnée pour calculer P en Pa.
convertir en bar
1 bar =1.105Pa
Bonjour excusez moi de vous déranger mais j'ai le même style d'exercice à faire pour vendredi ,si vous pouvez m'aider s'il vous plaît . Voici l'énoncé :
Calculer la pression osmotique en bar de l'eau de mer à 25°C . Pour simplifier , l'eau de mer sera assimilée à une solution aqueuse de chlorure de sodium de concentration massique cm:35g.L-1
Jai deja R=8,314J.K-1.mol-1
I=2
T=25+273.15K
Il me manque c :/
Merci de m'aider
Cdlt


