Inscription / Connexion Nouveau Sujet
L'acide fluorhydrique (constante d'équilibre, avancement final)
Bonjour à tous 
Je suis bloquée au niveau des valeurs de mes calculs qui me laissent penser que je me suis trompée.
On mesure la conductivité d'une solution aqueuse d'acide fluorhydrique HF de concentration initiale Co = 1,0.10^-3 mol.L-1 :  = 2,2.10^-2
= 2,2.10^-2
1/ Ecrire l'équation de la réaction de l'acide fluorhydrique avec l'eau
HF + H2O = F- --> F- + H3O+
2/ Donner l'expression littérale de la conductivité de la solution
 =
=  M+ * [M+] +
M+ * [M+] +  X- * [X-] = (
X- * [X-] = ( M+ +
M+ +  X-)*C avec C = [M+][X-]
X-)*C avec C = [M+][X-]
3/ En déduire la concentration H3O+
[H3O+] = (2,2.10^-2)/(5,54.10^-3 + 3,50.10^-2) = 5.4.10^-1 mol.L-1
4/ Calculer la constante d'équilibre K
K = [F-].[H3O+]/[HF] avec [F-] = [H3O+] = 5.4.10^-1
Donc K = (5.4.10^-1)²/10^-3 = 291.6 (là ça cloche non ??)
5/ La transformation associée à la réaction entre l'acide fluorhydrique et l'eau est-elle totale ?
Je ne sais pas le faire
6/ Calculer le taux d'avancement final
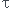 = xf/xm = 5.4.10^-1/10^-3 = 540 (là aussi ça cloche
= xf/xm = 5.4.10^-1/10^-3 = 540 (là aussi ça cloche  )
)
Merci d'avance
kaczka 
Salut, je pense savoir qu'elle est ton erreur, mais ça serait plus facile avec les données de l'exercic (conductivités molaires). La concentration [H3O+] que tu as trouvé doit être en mol.m-3. C'est une erreur courante. Pour passer de mol.m-3 à mol.L-1 tu multiplis ta concentration par 10-3.
Il me semble que ça rectifie pas mal de tes calculs, non ? Si c'est ça ton erreur tâche de t'en souvenir.
Par contre je ne sais pas comment répondre à la question 5/
Données :  H3O+ = 3.50.10^-2 ;
H3O+ = 3.50.10^-2 ;  F- = 5.54.10^-3
F- = 5.54.10^-3
Pour savoir si une réaction est totale ou pas on peut regarder le taux d'avancement finale, si il est égale à 1 alors la réaction est totale, si il est inférieur à 1 la réaction n'est pas totale. Mais là on te le fais calculer après, bon je pense que tu peux le calculer pour la 5 quand même. Pour ce genre de question c'est le taux d'avancement final qu'on utilise souvent.
Je cherche si il y n'a pas une autre méthode avec la constante d'équilibre K qu'on t'a fait calculer juste avant.
Oui, c'est ce que j'ai fait au début puis ça m'a semblé bizarre de voir qu'il demandait de calculer le taux d'avancement finale à la question suivante.
Je ne vois pas d'autres méthodes dans mon bouquin c'est ce qui me pose problème (ou alors j'ai raté quelque chose, ce qui est fort possible).
Est-ce que dans les données tu avais une constante d'équilibre théorique, celle qu'aurait put atteindre la réaction au maximum. Si tu en avais une, tu n'as qu'a comparer la valeur calculée à celle donnée dans l'exercice, si elles ne sont pas égales c'est que la réaction évolue encore donc qu'elle n'est pas totale.
Bon les réactions acido-basiques sont rarement totales d'après mon cours.
Voilà, j'espère que je t'ai bien aidé.


