Inscription / Connexion Nouveau Sujet
Ions polyatomiques
Bonjour,
Voilà j'ai une petite question, ça peut paraître vraiment bête mais bon il faut que j'éclaircisse ça dans mon esprit...
Pour l'ion NH4+ par exemple, j'ai bien compris que l'azote avait 4 liaisons covalentes au lieu de 3 normalement mais... d'où sort ce +? L'électron en moins, il est passé où? Je n'arrive pas à comprendre ce qui fait que la molécule est chargé...
Pareil pour NH2- !
Je sais c'est flou, mais j'espère que vous pourrez m'aider
Merci beaucoup
Cualqui'
Salut  !
!
Difficile d'expliquer ça en terminale... Tu connais la règle du duet et de l'octet? Tu saurais faire la structure de Lewis des molécules que tu proposes?
Je suis entre la Première et la Terminale mais j'ai un peu réfléchi au problème !
En se souvenant de la règle du duet et et de l'octet, l'atome N établit 3 liaisons covalentes or c'est ce qui se passe dans NH3 ou NH4+ car la définition d'une liaison covalente c'est la mise en place d'électrons en commun entre 2 atomes. Ainsi, pour NH4+, tu as 1 N, 3 H et 1 H+ qui est un proton (donc sans électron). Donc la règle de l'octet est respectée par contre je n'explique pas la présence de ce proton !
En restant dans le même problème, pourquoi parle-t-on de 2 ions fer, le Fe2+ et le Fe3+, pourquoi les deux sont-ils stables ?
Pour les molécules maintenant, comment s'établissent les liaisons dans le cas de l'ozone O3 ou du monoxyde de carbone CO ?
Il y a plusieurs représentations de Lewis pour un ion polyatomique donné. Du reste il y a d'autres règles dont il faut tenir compte (Hund et Klechkowski entre autres) pour expliquer le cas des ions fer.
Pour l'ozone il y a des histoires de résonance (mésomérie).
Pour CO là aussi deux structures de résonance sont envisageables.
Exemple avec CO : 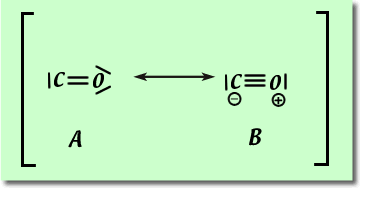
Pour l'ozone : 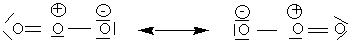
Par contre je ne saisis pas bien le problème avec l'ion ammonium et l'ammoniac
Oui je connais la règle du duet et de l'octet. Pour la formule de Lewis de NH4+, je mettrais un atome d'azote au centre entouré de 4 liaisons covalences avec l'ion hydrogène
Pour NH2-, je mettrais un azote au centre, lié à 2H et deux doublets non liants sur l'azote.
Ce que je n'arrive pas à saisir c'est pourquoi ces molécules sont chargées... J'ai vraiment du mal à exprimer mon problème en fait.
Je viens de trouver un schéma sur wikipedia
http://upload.wikimedia.org/wikipedia/commons/e/e0/Bildung_Ammonium.svg
oOvinceOo je pense que tu as raison
Bonjour shadowmiko en fait je crois que j'ai compris
Dans NH2-, N a 6 électrons alors que normalement il en a 5 sur sa dernière couche (vu que Z=7) donc comme il a un électron en plus, la molécule a une charge négative...
Et 'l'inverse pour NH4+
C'est ça?
Merci beaucoup de cet éclairage ! En fait c'est l'écriture qui nous perturbe, je crois !
Car lorsque l'on lit NH4+ on a l'impression qu'on parle de H+ (d'un proton) et non pas de l'atome d'azote qui a perdu un électron et qui doit donc faire une liaison covalente supplémentaire pour satisfaire la règle de l'octet ! Mais au final tout cela est très simple ! =D
Merci pour ce partage de point de vue très constructif !
Re  !
!
Tu peux aussi faire le lien avec les réactions acide/base.
Du reste écrire Lewis entre deux formes peut vraiment aider à y voir plus clair 
Il n'y a pas de quoi, si vous avez d'autres questions 
Pire encore, un exemple qui allie la particularité de NH4+ par exemple et de l'ozone O3 : le cas NO3+ !
La chimie, c'est vraiment génial !
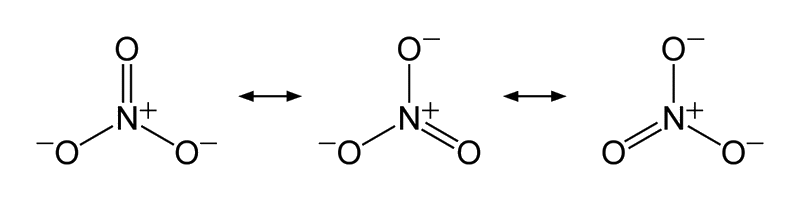
Derrière NO3- se cache en fait N+O32-. En fait pour satisfaire la règle de l'octet, seul un oxygène peut établir une double liaison et celle-ci se déplace au cours du temps alors que les deux autres gagnent un électron et que l'azote en perd un ! Ainsi on 2- + 1+ = 1- d'où NO3- !
J"adore ! ;D
Si tu adores je te conseille d'étudier la chimie dans le supérieur, ah les formes limites de résonance c'est mignon hein? 
Mais c'est bien mon intention ... J'ai un beau projet de prépa PCSI en route et la chimie, ses mystères, ses particularités me fascinent ! D'ailleurs si tu en as à me faire partager ... je t'en prie (de sorte que je puisse comprendre bien sûr !) 



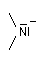
 Chaque chose en son temps serait plus juste
Chaque chose en son temps serait plus juste 
