Inscription / Connexion Nouveau Sujet
Geometrie des atomes
bonjour, je comprends pas cet exo. quelqu'un pourrait m'aider svp ?
recopier la molécule et représenter les doublets non liants, représentation de lewis sans justifier. et indiquer la géométrie autour des atomes numéroté
1 2 3 4 5
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
le ":" est un trait
Bonjour.
Je vous montre la technique pour un des 5 atomes et je vous laisse chercher les 4 autres.
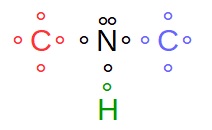
Pour l'atome noté 2, càd, l'atome d'azote N...
n° atomique de l'azote : Z = 7
répartition électronique : (K)2 (L)5
La couche externe (couche L) étant saturée à 8 e-, il en manque 3
L'un est apporté par l'atome H, les deux autres sont apportés par les deux atomes C voisins ; la mise en commun de ces trois paires d'électrons permet à l'azote d'établir 3 liaisons covalentes.
Il reste alors une paire d'électrons non appariés sur l'atome d'azote.
(cf premier schéma)
Au final, l'atome d'azote (atome noté 2) est entouré de 4 doublets, 3 doublets liants et 1 doublet non liant ; la règle de l'octet est donc satisfaite.
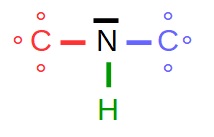
(cf second schéma)
OK ?
J'ai oublié la géométrie de l'atome N.
En méthode VSEPR, il s'agit d'un type AX3E ; la forme géométrique est pyramidale.
la consigne première est d'abord de placer les doublets non liants dans la molécule
1 2 3 4 5
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
Sur le premier schéma, j'ai représenté les électrons entourant les atomes.
Sur le second, j'ai représenté les doublets électroniques, càd les paires d'électrons, ...
-qui sont mis en commun entre 2 atomes (doublets liants [rouge, vert ou bleu] sur le schéma)
-ou qui appartiennent à un seul atome (doublet non liant [noir] sur le schéma)
la consigne première est d'abord de placer les doublets non liants dans la molécule
les liaisons covalentes sont présentes sur
-- -- -- -- --
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
--
mais pourquoi représenter les liaisons alors qu'il faut que la géométrie des atomes?
Maintenant, si la méthode que je vous ai proposée ne vous convient pas, vous êtes libre de procéder comme vous l'entendez.
les liaisons covalentes sont présentes sur
-- -- -- -- --
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
--
la représentation de Lewis est valable que pour la molécule et en ce qui concerne les atomes numérotés il faut faire la représentation géométrique
oui cela correspond aux doublets non liants, lesquels ne sont pas à leurs places ?
oui cela correspond aux doublets non liants, lesquels ne sont pas à leurs places ?
Vous devez donc revoir l'ensemble.
la représentation de Lewis est valable que pour la molécule et en ce qui concerne les atomes numérotés il faut faire la représentation géométrique
-- --
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
--
d'accord je comprends mieux maintenant merci, je vais utiliser votre méthode
Ca ne va toujours pas...
Dans votre proposition, les atomes O ne sont entourés que par 3 doublets (2 liants et 1 non liant) ; la règle de l'octet n'est donc pas satisfaite !
pour l'atome numéro 1j'ai trouvé que c'était une molécule tétraédrique
numéro 3 une molécule plane coudée
numéro 4 une molécule tétraédrique
et la 5 une molécule coudée
Non, ça ne va toujours pas et on ne va pas en sortir avec ce genre de représentation.
Vous dessinerez les doublets sur votre copie de façon habituelle mais sur le site, ce n'est pas très commode.
Je vous propose de procéder ainsi...
Atome n°1 : C nombre de doublets liants ...... nombre de doublets non liants .....
Atome n°2 : N nombre de doublets liants 3 nombre de doublets non liants 1 (celui ci, c'est moi qui l'ai fait).
etc...
À vous de terminer
c'est quoi qui ne va pas ?
Atome n°1 : C nombre de doublets liants 0 nombre de doublets non liants 0
Atome n°2 : N nombre de doublets liants 3 nombre de doublets non liants 1
atome 3: C nombre de doublets liants 0 nombre de doublets non liants 0
atome 4: O nombre de doublets liants 3 nombre de doublets non liants 2
atome 5: C nombre de doublets liants 0 nombre de doublets non liants 0
Au fait, quelque chose ne va pas dans votre message de 13 h 19...
1 2 3 4 5
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
: :
OH OH
Quant aux formes géométriques que vous proposez, certaines sont à revoir : 3, 4 et 5 !
vous disiez que seul les atomes N et O ont les doublets non liants donc je ne comprends pas ce qu'il ne va pas...
-- --
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
--
Atome n°1 : C nombre de doublets liants 0 nombre de doublets non liants 0
Atome n°2 : N nombre de doublets liants 3 nombre de doublets non liants 1
atome 3: C nombre de doublets liants 0 nombre de doublets non liants 0
atome 4: O nombre de doublets liants 3 nombre de doublets non liants 2
atome 5: C nombre de doublets liants 0 nombre de doublets non liants 0
La somme des doublets liants et non liants de chacun de ces atomes doit être égale à 4.
Avez vous étudié votre leçon avant de chercher cet exercice ?
Revoyez tout cela, je me déconnecte pour ce soir, je regarderai vos nouvelles propositions demain.
en ce qui concerne la molécule entière c'est juste ?
-- --
CH3-CH2-NH-C(double liaison) CH-O-C(triple liaison) CH
:
OH
--
Ces tirets -- représentent-ils deux électrons (càd un doublet non liant) ou deux doublets non liants ?
A moins de posséder de bonnes connaissances en chimie organique, on ne peut se sortir de ce type d'exercices qu'en procédant avec méthode, comme je vous l'ai expliqué dans mon premier message ; en refusant cette recherche méthodique vous avez peu de chances de parvenir à la solution.
A mon avis, cette molécule n'existe pas et je pense que votre professeur l'a inventée de toutes pièces, de façon à vous obliger à un travail méthodique ; manifestement, c'est raté...


