Inscription / Connexion Nouveau Sujet
Forme géométrique et structure de l'atome carbone.
Bonjour ,
Merci d'avance. 
Pour chacun des types de liaisons suivants , donner le nom de la liaison Carbone- Carbone , la forme géométrique et la structure de l'atome de carbone.
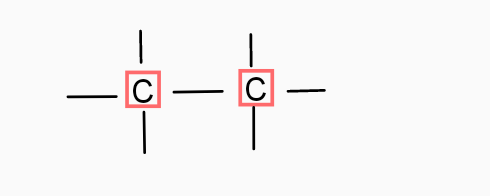
1) 
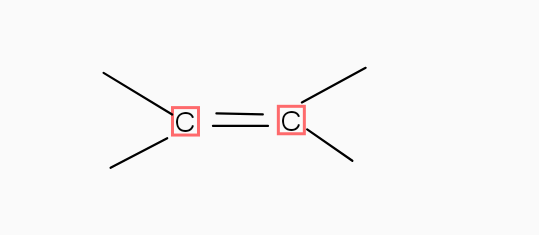
2) 
3)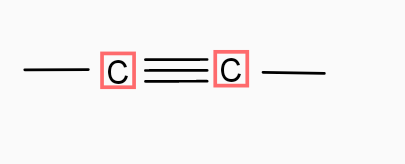
Réponses
1) Le nom de la liaison Carbone - Carbone est : Une liaison monovalente.
La forme géométrique : j'en sais rien..
La structure de l'atome carbone : pareil..
2) Le nom de la liaison Carbone - Carbone est : Une liaison divalente.
La forme géométrique : j'en sais rien..
La structure de l'atome carbone : pareil..
3) Le nom de la liaison Carbone - Carbone est : Une liaison trivalente.
La forme géométrique : j'en sais rien..
La structure de l'atome carbone : pareil..
Bonjour
Ne pas confondre le nombre de liaisons et la valence.
Pour les structures géométriques ; la théorie VSEPR : cela te dit quelque chose ?
La théorie VSEPR est une méthode destinée à prédire la géométrie des molécules en se basant sur la théorie de la répulsion des électrons de la couche de valence. Elle est aussi connue sous le nom de « théorie de Gillespie ».
La valence d'un atome est le nombre de liaisons covalente que cet atome est susceptible d'établir pour se stabiliser. Sauf cas très particulier qui n'est pas au programme de l'enseignement secondaire, la valence du carbone vaut 4. Le carbone établit toujours 4 liaisons covalentes :
premier cas : 4 liaisons covalentes simples dites liaisons  ;
;
deuxième cas : deux liaisons covalentes simples ( ) et une double liaison (liaison
) et une double liaison (liaison  et liaison
et liaison  )
)
troisième cas : une liaison covalente simple et une triple liaison (une  et deux de type
et deux de type  ).
).
Pour les structures géométriques : regarde sur wikipedia en prenant les exemples du méthane, de l'éthane et de l'éthyne. Tu as des schémas en 3D très bien faits. Tu peux justifier simplement ces structures par la théorie VSEPR.
Ah ok ,
Je crois je comprends un peu..
1) Le nom de la liaison Carbone - Carbone est : Une liaison simple.
La forme géométrique :
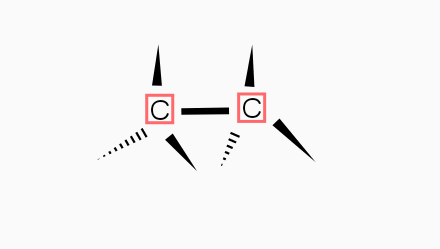
La structure de l'atome carbone
Bonjour à vous deux,
@kamikaz : encore une fois, les fiches de l'île sont tes amis, donne-toi la peine d'y jeter un coup d'oeil :
![]() De la structure à l'électronégativité des entités et à la polarité des molécules
De la structure à l'électronégativité des entités et à la polarité des molécules

Au niveau des atomes de carbone , lié a un seul atome de carbone par une liaison simple (C-C) pour 1) , à un atomes de carbone par deux liaisons simples pour 2) et triplement liés par une triple liaison Carbone - Carbone , les molécule sont linéaires.
Par conséquent , pour la structure du carbone :
1) Le carbone est monogonal
2) Le carbone est digonal
3) Le carbone est trigonal.
La molécule n'est linéaire que dans le cas 3 de la triple liaison carbone carbone.
Le mot "trigonal" n'est pas adapté à la situation ; les mots "monogonal" et "digonal" ne sont pas, à ma connaissance, des mots français...
A propos des structures, quelques mots simples sur la méthode VSEPR adaptés à ce niveau. Les liaisons covalentes correspondent à des doublets d'électrons partagés entre deux atomes. Ils ont donc tendance à se repousser entre eux (répulsions électrostatiques entre charges de même signe). Conséquence : les différents axes de liaisons établies par un même atome s'orientent dans l'espace de façon à être les plus éloignés les un des autres.
Cas n° 3 où C établit deux liaisons : une simple et une triple : pour être le plus éloignés possible l'un de l'autre, les deux axes s'orientent à 180° l'un de l'autre. Cela conduit à une structure linéaire ; exemple : l'éthyne (voir documentation déjà fournie).
Cas n° 2 où C établit trois liaisons : deux simples et une double ; pour être les plus éloignés possible les uns des autres, ces trois axes s'orientent dans un même plan avec des angles de 120. Donc : structure plane avec angles de liaisons de 120°. Exemple : l'éthène.
Cas n° 1 où C établit quatre liaisons covalentes simples : pour être les plus éloignés possible les uns des autres, ces quatre axes s'orientent vers les quatre sommet d'un tétraèdre dont le sommet est occupé par le noyau C. On obtient une structure tétraédrique avec des angles de liaisons de 109°28' . Exemple : le méthane.


